作者:北北
近日,合源生物首个核心产品赫基仑赛注射液(拟定)(CNCT19细胞注射液,Inaticabtagene Autoleucel)的上市申请获得国家药品监督管理局(NMPA)受理,用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL),这将是中国首个原创的靶向CD19的CAR-T(Chimericantigen receptor T-cell,嵌合抗原受体T细胞)产品,也是中国首个白血病治疗领域获得NDA受理的CAR-T产品,将补足现有白血病患者的CAR-T治疗空白。
此事再次将大众的视线聚焦到当下研究火热的CAR-T领域。全球CAR-T疗法的元年始于2017年诺华研发的全球第一款获批的CAR-T药物Kymriah的上市。自此之后,越来越多新药物的获批上市及适应症的拓展,截至2022年前三季度 FDA共批准6款CAR-T药物上市,NMPA也批准了两款引进CAR-T产品用于淋巴瘤治疗,全球范围内CAR-T药物年内实现了超18亿美元的销售额。
本文简要概述中国CAR-T细胞临床试验的范围(尤其是血液学恶性肿瘤领域),分析相关政策,总结企业和资本支持的特点,并探讨CAR-T细胞治疗在中国的成就和挑战,为进一步促进细胞治疗及其临床应用的发展提供更好的理解。
CAR-T疗法发展历程
CAR-T疗法属于过继性T细胞转移(adoptive T-cell transfer,ACT)的一种,CAR-T细胞技术的核心为能够通过将识别肿瘤相关抗原(TAA)的scFv和胞内信号域“免疫受体酪氨酸活化基序”(ITAM,通常为CD3ζ)在体外进行基因重组,生成重组质粒,再在体外通过转染技术转染到患者的T细胞,使患者T细胞表达肿瘤抗原受体。
转染后经过纯化和大规模扩增后的T细胞,就是所谓的CAR-T细胞。完整的CAR-T结构包括抗原结合区、跨膜链接区和胞内信号区三个部分。从而使得T细胞实现了抗原特异性的非MHC限制的活化及其效应的增强。
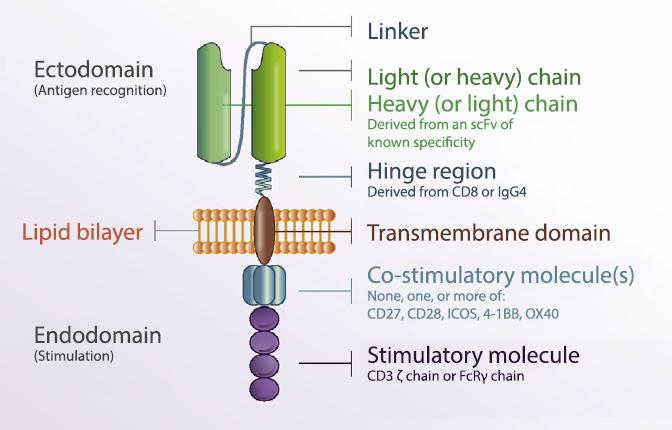
图1. CAR结构
简而言之,CAR(嵌合抗原受体)是一种基因工程技术制造的人工受体分子,它可以赋予免疫效应细胞(如T淋巴细胞)针对某个靶点抗原表位的特异性,从而增强T淋巴细胞识别抗原信号与活化的功能。继而回输淋巴细胞以实现抗肿瘤,抗病毒或抗炎作用。CAR-T细胞疗法在血液恶性肿瘤的治疗中取得了显著的成功。
目前,CAR-T细胞疗法已经实现了5次技术迭代,总结如下:
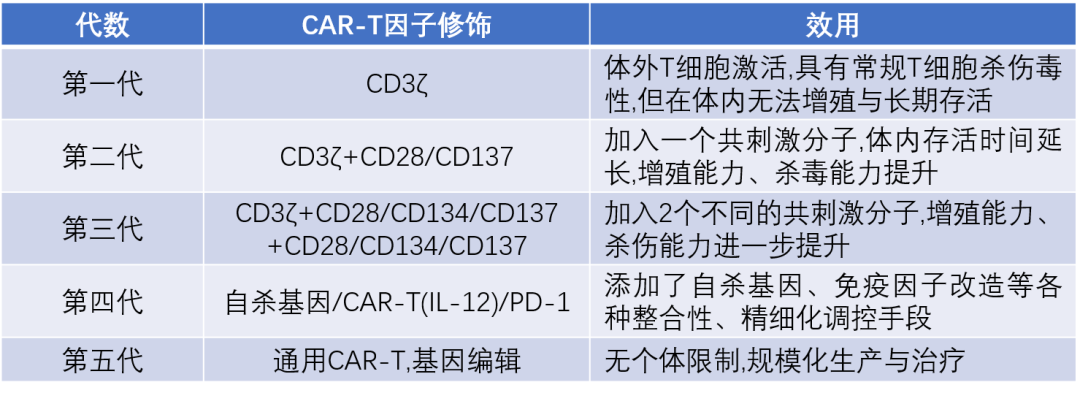
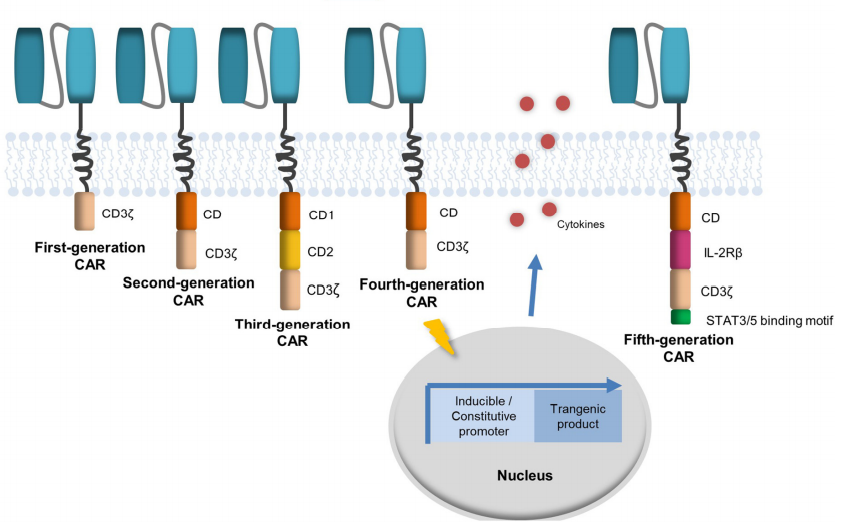
图2. CAR-T技术的迭代
第一代的CAR仅依赖于CD3ζ介导T细胞激活,由于缺乏胞内共刺激信号,并不能提供长时间的T细胞扩增信号和持续的抗肿瘤效应,临床疗效有限;
第二代的CAR结合了激活和共刺激信号,如CD28/CD137;
第三代的CAR结合了两个共刺激和激活信号,如CD28、CD137、CD134等;
第四代的CAR则是引入了粗盐症细胞因子IL-12等和共刺激配体,主要目的是克服肿瘤免疫微环境的抑制;
第五代的CAR是在第二代的基础上,添加了激活其他信号通路的共刺激结构域,目前仍处于研发阶段。
而随着全球CAR-T治疗技术的不断推陈出新,资本的加速投入,我国CAR-T细胞治疗赛道近年来也迎来告诉发展。
中国CAR-T疗法进展
在过去9年中,CAR-T细胞疗法在中国各地的使用逐渐增多:从2013年,首次进行CAR-T淋巴细胞临床试验;到2017年,已经成为CAR-T细胞相关临床试验数量全球第一;再到2021年,累计为细胞治疗公司提供了23.7亿美元的资金支持,CAR-T细胞相关临床试验和基础研究的数量也借此显著增加。
以上成绩的取得是诸多因素的结果:强大的政府支持、资本流入、巨大的患者需求、独特的医疗体系以及医生和科学家的努力。
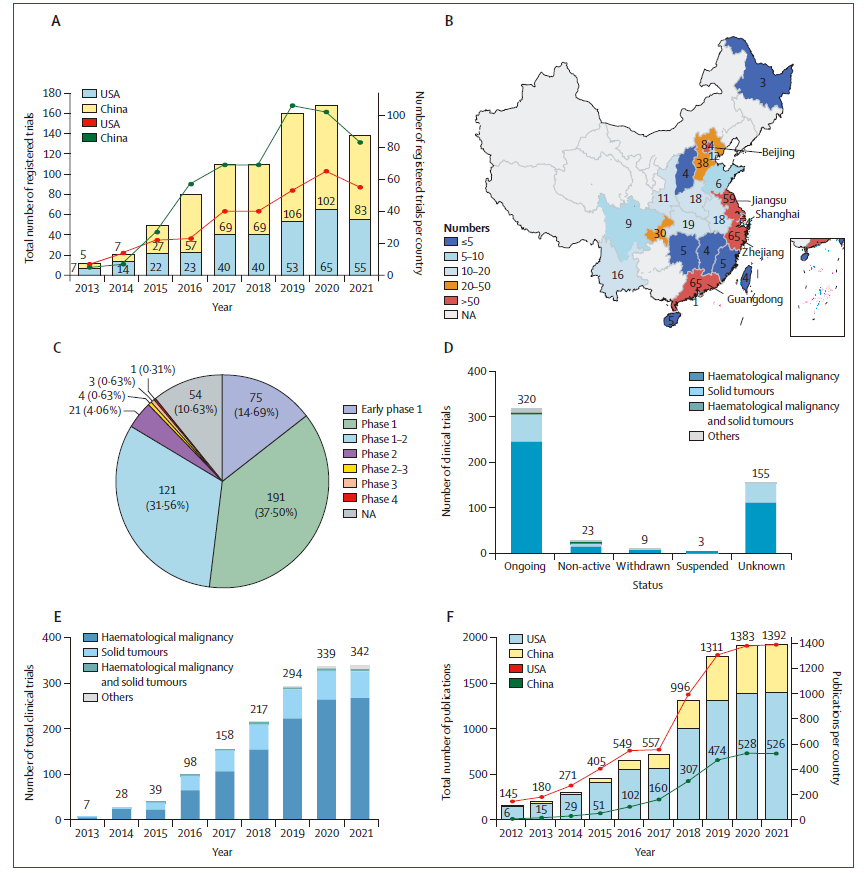
图3. 与美国相比,中国CAR-T细胞疗法临床试验的范围和分布
A.每年新注册的临床试验(左轴为条形,右轴为直线);B.中国试验的地理分布;C.中国临床试验阶段;D.中国临床试验现状;E.中国每年针对的疾病类型;F.每年新的研究出版数量
截至2021年 11月15日,中国已注册714项CAR-T细胞治疗临床研究,其中,510项注册在ClinicalTrials.gov, 204项研究注册在Chinese Clinical Trial Registry。
由于CAR-T细胞疗法需要先进的设备和条件,进行CAR-T细胞治疗的研究中心主要位于中国东部沿海经济城市,如北京(n=84)、广东(n=65)、浙江(n=65)、江苏(n=59)和上海(n=54)。320项涉及CAR-T细胞治疗的临床研究正在进行中,大部分(约70%)仍处于临床I期或临床I/II期。由于进行了大量试验,CAR-T细胞治疗相关文章也出现了稳步增长态势。与全球应用一致,CAR-T细胞疗法在中国已广泛应用于血液恶性肿瘤,尤其是B细胞恶性肿瘤。
此外,中国的研究人员一直在积极拓展CAR-T细胞的临床应用范围,342项试验中有13项(3%)登记了恶性疾病以外的疾病,119项(23%)聚焦实体瘤。CAR-T细胞疗法中最常选用的实体肿瘤包括肝癌、胰腺癌和脑癌,而非恶性肿瘤疾病主要包括自身免疫性疾病、传染病和POEMS综合征。具体而言,CAR-T细胞靶向自身免疫性疾病的试验包括系统性红斑狼疮、硬皮病、肾炎、干燥综合征、视神经脊髓炎谱系障碍和针对感染性疾病的CAR-T细胞试验包括艾滋病、慢性活动性EB病毒感染和新冠肺炎。
图4. CAR-T细胞疗法在中国临床治疗中的应用
A.血液学恶性肿瘤; B.细胞血液学恶性肿瘤; C.所有疾病; D.实体瘤; E.除了癌症;CAEBV:慢性活动性EB病毒感染;NMOSD:神经脊髓炎光谱障碍。
随着临床试验整体数量的增加,中国涉及CAR-T细胞的研究性新药应用数量也在不断增加。迄今为止,来自32家中国生物制药公司的73份CAR-T细胞相关新药研究申请已提交给NMPA,其中36份已被批准用于人体临床试验。鉴于CAR- T细胞疗法对B细胞恶性肿瘤、急性淋巴细胞白血病和非霍奇金淋巴瘤的疗效证据,是目前临床研究中,CAR-T细胞疗法临床试验最长选择的适应症。
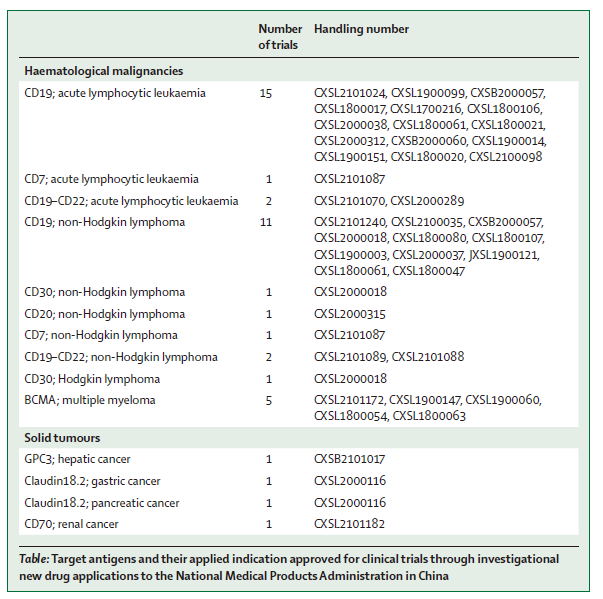
表1. NMPA统计的临床试验涉及的靶抗原及其应用适应症
CAR-T细胞疗法在中国进展迅速的关键因素为积极的政策和法规刺激。《中华人民共和国国民经济和社会发展第十三个五年计划(2016—2020年)》中表示,计划扩大基因组学和其他生物医学研究领域的生物技术。
中华人民共和国国务院于2016年11月29日发布的《国务院关于印发国家“十三五”战略性新兴产业发展规划的通知》明确强调,要加快包括细胞治疗在内的生物技术产业的创新和发展步伐。在国家政策的指导下,相关部委颁布了相关法规以促进细胞疗法的发展。
随后,NMPA发布了一系列法规和指南,包括化学、制造和控制、临床前研究和临床研究。尽管有许多临床研究正在进行,但很少有产品真正上市并获得商业应用,特别是中国国内生产的药物,这也反映了研究和产出之间的不平衡,中国CAR-T细胞疗法仍任重道远。
充足资本支持下的CAR-T细胞疗法发展自2015年国务院关于改革药品和医疗器械审评、审批流程的意见发布以来,中国生物技术行业已开始快速开发CAR-T细胞产品,资本和资金不断增加。
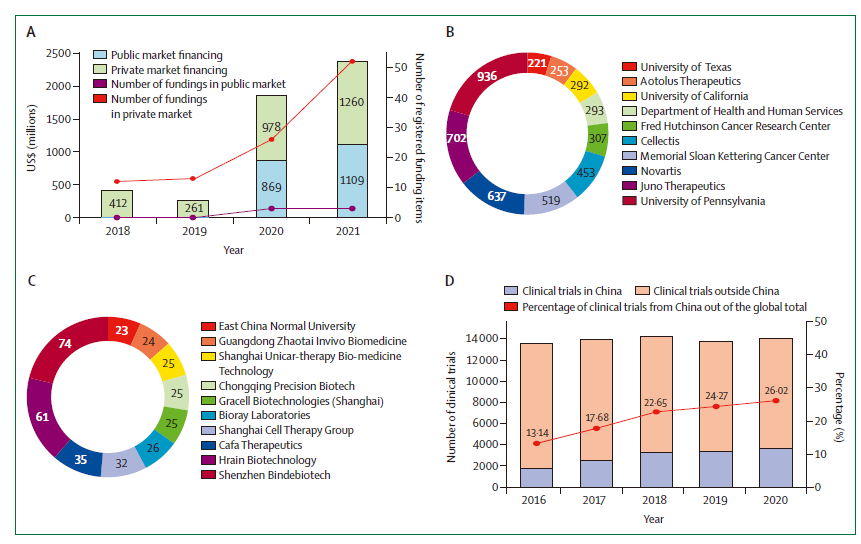
图5. 中国CAR-T细胞治疗的资金支持和企业发展
A.公共和私人市场融资;B.全球专利申请人;C.中国专利申请人;D.与全球临床试验发展的比较
如上图所示,2018—2021年,中国细胞治疗公司累计筹集资金23.7亿美元,年复合增长率为45%,公开宣布的金融交易109笔。庞大的患者群体和快速增长的临床试验系统(人口庞大、临床试验认知和参与度提高、临床试验和研究者增长)。
CAR-T疗法的挑战
CAR-T治疗在高速发展之际,也面临着几大局限性。CAR-T细胞疗法的局限性包括:A. 抗原逃逸;B. 脱靶效应;C. CAR-T细胞转运及浸润;D. 免疫抑制微环境;E. CAR-T细胞相关的毒性。
上述的局限性可以概括为实体瘤领域难以攻克、CAR- T治疗本身的毒副反应,而更为制约CAR- T治疗广泛应用的是CAR- T疗法的高售价。如何有效从自体到异体的转换,是核心所在。随着中国CAR-T治疗赛道的火热,在以下的几个方向中,也颇有建树,对CAR-T目前面临的治疗局限性有一定的引导作用,总结如下:
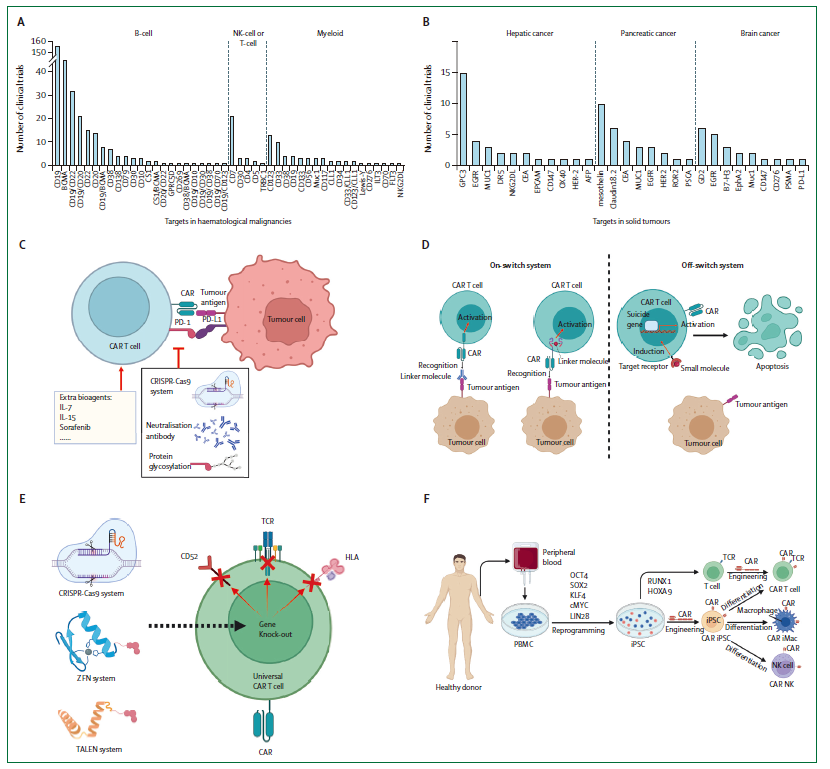
图6. CAR-T细胞疗法在中国的进展
A. 血液学恶性肿瘤的靶点;B.实体瘤中的靶点;C.增强功能;D.精确调节;E.通用嵌合抗原受体细胞疗法;F.iPSC(诱导性多能干细胞)技术与CAR-T结合
目前,越来越多的临床试验开始尝试将CAR-T细胞疗法用于实体瘤,关键点就是实体瘤靶点的选择,下图汇总了常用的靶点。其中值得一提的是,国内企业在胃癌中高度表达的Claudin18.2靶点上,CAR-T进度处于全球领先水平。
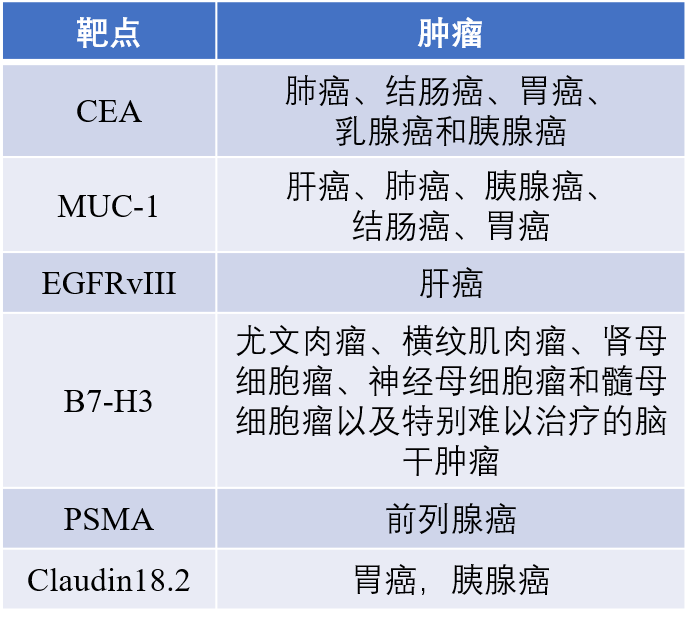
图7. 实体瘤潜在靶点
Claudin18.2在所有胃癌患者中的阳性率可以达到近60%,具有更广泛的患者获益可能。从而在胃癌领域,针对Claudin18.2的治疗性抗体理论上具有更大的抗癌潜力和更低的毒性。全球范围内靶向Claudin18.2靶点的产品类型涉及单克隆抗体、双特异性抗体、CAR-T以及ADC,几乎包含了当下主要的产品形式,是潜在的明星靶点。
与抗PD-1单抗向双特异性单克隆抗体转变一样,单靶点CAR-T细胞疗效也受限于肿瘤抗原的异质性,开始向多靶点CAR-T细胞疗法转变。所谓的多靶点CAR-T细胞,主要是设计用于靶向不同的肿瘤抗原,包括具有两个CAR的双CAR-T细胞或具有多个单链抗体(scFv)的串联CAR-T细胞。另外,鉴于免疫联合其他治疗方式存在的协同抗肿瘤效果,CAR-T细胞疗法也开始与创新疗法联用:包括病毒或树突状细胞在内的疫苗、纳米颗粒或溶瘤病毒。
我国学者在CAR-T细胞中引入“开/关”概念,精确调节其生物学功能,及时避免细胞因子释放综合征(CRS)、神经毒性综合症(ICANS)、移植物抗宿主病(GVHD)等毒副反应的发生。严重副作用仍是CAR-T细胞疗法临床广泛应用的主要障碍,国内对CAR-T细胞精准调控的研究报道较少,因此精准调控设计是中国下一代 CAR-T细胞设计最重要的方向之一。
通用型CAR-T(UCAR-T)细胞具有健康供者来源、制备成功率高、适用性范围广等特点,我国学者研发的通用型CAR-T细胞在治疗B-ALL和T-ALL中疗效显著,且CRS、ICANS、GVHD等毒副反应低。但是,仍存在一些局限性,其中GVHD是阻碍临床应用的主要挑战之一,因为现有技术仍无法完全敲除T细胞受体,且基因编辑会增加基因突变、克隆扩增和潜在的靶向、非肿瘤效应的风险。
人类诱导多能干细胞(iPSC)是用于细胞治疗的可扩展制造的理想CAR-T细胞来源。iPSC细胞具有无限增殖能力,可以分化成身体所有特化的细胞类型,可以制造临床规模数量的具有所需抗原特异性的T细胞。iPSC可以进行基因改造,使其具有增强的特异性和效应功能,在体外产生大量分化程度较低的肿瘤抗原特异性T细胞,实现体内回输后的高持久性。因此,将人类肿瘤抗原特异性T细胞重新编程为iPSC,然后再分化为T细胞系具有产生恢复性肿瘤抗原特异性T细胞的潜力。
总 结
CAR-T细胞治疗已发展了三十余年,在血液肿瘤领域一路高歌猛进,随着CAR分子设计、转导方法、靶点优化和创新联合疗法的应用,期望在不久的将来,CAR-T 细胞疗法能够在实体瘤领域带来更多患者获益。特别是在一系列国内利好刺激之下,我国的CAR-T细胞治疗领域能够有更多的里程碑事件涌现,造福全球患者。
参考资料:
1. Hu Y, Feng J, Gu T, Wang L, Wang Y, Zhou L, Hong R, Tan Su Yin E, Zhang M, Lu P, Huang H. CAR T-cell therapies in China: rapid evolution and a bright future. Lancet Haematol. 2022 Dec;9(12):e930-e941. doi: 10.1016/S2352-3026(22)00291-5. PMID: 36455608.
2. Gill, S., M.V. Maus, and D.L. Porter, Chimeric antigen receptor T cell therapy: 25years in the making. Blood Reviews, 2016. 30(3): p. 157-167.
3. Abreu, T.R., et al., Current challenges and emerging opportunities of CAR-T cell therapies. Journal of Controlled Release, 2020. 319: p. 246-261.
编辑:小果果,转载请注明出处:https://www.cells88.com/zixun/hydt/24148.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫