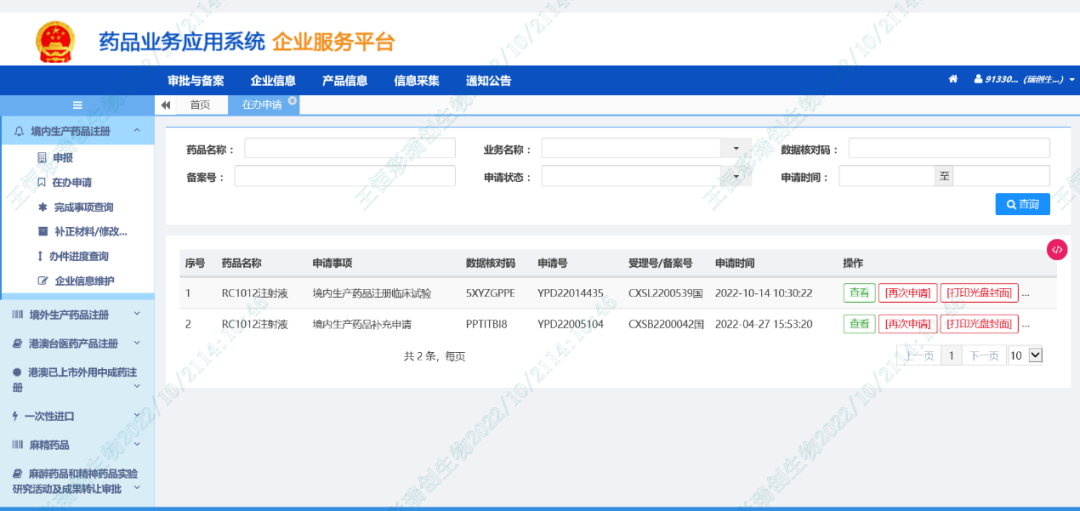
2022年10月22日/医麦客新闻 eMedClub News/–2022年10月21日,瑞顺生物(Wyze Biotech CO.,Ltd.),一家专注于以现货通用型DNT细胞为技术平台的全球创新免疫治疗细胞药研发及商业化的生物医药公司,今日宣布其全资子公司瑞创生物技术有限公司(下称“瑞创生物”)递交的RC1012注射液关于“预防急性髓系白血病异基因造血干细胞移植后复发” 新适应症IND申请,获得国家药品监督管理局(NMPA)药品审评中心(CDE)正式受理,受理号:CXSL2200539国。
关于瑞创生物:
编辑:小果果,转载请注明出处:https://www.cells88.com/zixun/hydt/19535.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫