撰文:清华大学 Dr.Hu
专家审核:江苏大学附属医院 李晶 教授
近日,根据报道,国内中南大学湘雅三医院在CAR-T免疫细胞治疗晚期肝癌取得突破。63岁患者在接受CAR-T免疫细胞治疗后,体内的肝脏肿块明显缩小,淋巴结转移灶消失,目前已经恢复劳动能力。这是全国首个运用基因编辑自体T细胞进行晚期肝癌治疗的免疫疗法。

也在近期,《自然》和《细胞》等著名杂志相继发表研究,为攻克CAR-T免疫细胞治疗实体肿瘤提供了新的见解。
CAR-T免疫细胞治疗癌症的研究在如火如荼的开展中,相继的新闻报道以及期刊杂志报道让人们看到了这一领域的新曙光。
CAR-T免疫细胞治疗实体瘤的挑战
CAR-T免疫细胞疗法是将经过改造后T免疫细胞重新回输到患者体内,达到杀伤肿瘤的目的。CAR-T免疫细胞疗法对血液肿瘤产生了巨大的疗效。到目前为止,全球已经有8款CAR-T免疫细胞疗法获批上市,针对的适应症全部为血液肿瘤。针对实体肿瘤的CAR-T疗法仍需要突破。
与治疗血液肿瘤相比,由于肿瘤微环境中T细胞效应因子功能的抑制,CAR-T细胞治疗实体肿瘤的整体疗效要低得多,大多数患者没有持久的反应。肿瘤对CAR-T治疗的抗性,主要是由于T细胞功能障碍。人们已经投入了大量的努力来确定导致T细胞功能障碍的基因和通路。然而,到目前为止,仍然对T细胞功能调节因子的全面了解。
攻克实体肿瘤的新策略
近年来,全球多个研究团队开展了CAR-T免疫细胞治疗实体肿瘤的研究,以期取得新突破。近日,国际知名医学期刊《Nature》刊发文章精确地发现了增强抗原特异性T细胞的功能的基因,并探究了这些基因是如何调控抗癌相关的免疫细胞功能的[1]。这一研究将为CAR-T免疫细胞治疗实体瘤提供新的思路。

首先,研究人员对T细胞进行全基因组筛选,筛选到的LTBR是促炎细胞因子分泌的强驱动因子。LTBR细胞对激活诱导的细胞死亡也具有更强的抵抗力,并在重复刺激后保留了更大的功能。其次,研究人员发现LTBR的过表达显著改善T细胞的功能。作者还发现,添加LTBR会重建T细胞的基因组,触发许多其他增强T细胞功能的基因的表达。它们在弥漫性大B细胞淋巴瘤患者功能丧失的T细胞中同时添加了LTBR和CAR,发现T细胞功能得到了提升。添加LTBR还使T细胞分泌更多的细胞因子,这对T细胞的抗肿瘤活性至关重要。
总体而言,在这一研究中,研究人员确定了能够增强免疫细胞的基因,使它们能够在体内持续存在,并且提高它们攻克肿瘤细胞的能力。未来,利用修饰基因增强T细胞的功能,不仅在血液肿瘤上带来更大的治疗效果,而且还会在靶向实体肿瘤上发挥关键作用。
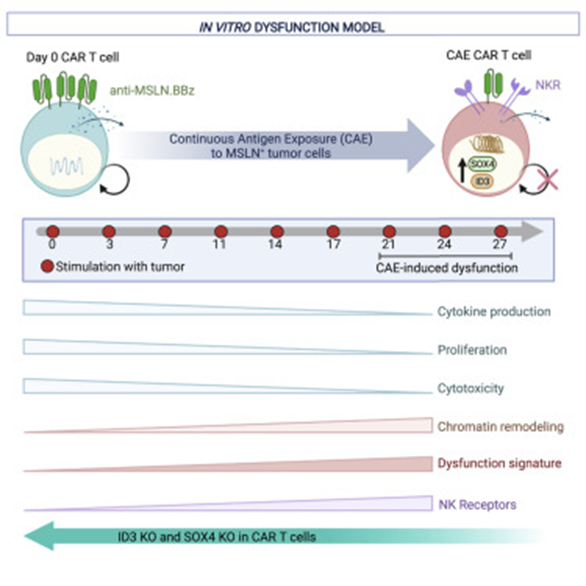
图片来自文献2
另一项发表在cell上的文章,也给CAR-T细胞治疗实体肿瘤带来新思路。这是美国宾夕法尼亚医学院 Carl June 团队发表的论文[2]。这项研究基于一个新的研究模型全面解析用于攻击胰腺肿瘤的CAR-T细胞的衰竭过程.

他们观察到,模型中的CAR-T细胞衰竭过程与患者的T细胞非常相似。该模型还发现两种遗传调节因子—ID3和SOX4,在T细胞衰竭过程中发挥着重要作用,将它们沉默后将延长CAR-T细胞的效应时间。
小结与展望
目前,基于免疫细胞的肿瘤治疗策略是一热门研究领域,已经有许多临床研究正在或者已经评估了其安全性与疗效。同时,有一些存在问题也有待解决,例如免疫细胞在实体肿瘤中的疗效仍有待提高。CAR-T细胞治疗实体瘤的潜力是显而易见的,未来的临床转化仍然需要通过精心设计的试验,结合密切的患者监测和严格用药规则,再加上详细的临床前转化研究,才能实现。
参考资料
1. Legut, M., Gajic, Z., Guarino, M.et al.A genome-scale screen for synthetic drivers of T cell proliferation. Nature (2022). https://doi.org/10.1038/s41586-022-04494-7
2. An NK-like CAR T cell transition in CAR T cell dysfunction
https://www.sciencedirect.com/science/article/abs/pii/S0092867421013313
编辑:小果果,转载请注明出处:https://www.cells88.com/zixun/hydt/11360.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫