介绍
近年来,细胞治疗领域取得了显着进展,包括美国食品和药物管理局(FDA)批准嵌合抗原受体(CAR) T细胞疗法作为治疗复发或难治性 CD19+恶性肿瘤包括 B细胞急性淋巴细胞白血病(B-ALL) (1)、弥漫性大B细胞淋巴瘤(DLBCL)(2)和套细胞淋巴瘤(3)。
与T细胞一样,自然杀伤(NK)细胞是具有强大抗肿瘤能力的免疫效应细胞。然而,与T细胞不同的是,NK细胞不会产生移植物抗宿主病 (GvHD),而且它们的使用也不会导致严重的毒性,例如细胞因子释放综合征 (CRS) 或免疫效应细胞相关的神经毒性综合征ICANS(4、5)。
因此,我们假设缺失自我假设(8)所假设的起始信号可以作为通用替代“信号 1”,而共激活受体2B4和4-1BB(11, 12)可以作为“信号 2”。
本文将IL-21R(13)指定为“信号3”的接收器,即细胞因子刺激物,它补充了另一种重要的细胞因子IL-15,IL-15经过基因工程设计用于我们的CAR NK细胞的组成型分泌(9)。因此,我们将CD48、4-1BB 配体和膜结合IL-21 (mbIL-21)设计到基于K562的呈递细胞上,作为三种信号受体的反配体。这组最小的抗原刺激物形成了我们的通用饲养细胞,用于研究和临床级非转导和装甲CAR NK细胞的稳健扩增,而不管CAR分子靶向的抗原如何。
试验材料和方法
逆转录病毒转移构建体合成
编码CD48、CD137 配体 (4-1BBL)和膜结合白细胞介素(IL)-21 (mbIL-21)的逆转录病毒载体按规格合成。瞬时逆转录病毒上清液的制备如前所述(1)。
用含有CD48、CD137配体和mbIL-21转基因的逆转录病毒上清液连续转导K562细胞,并在每次转导后进行有限稀释克隆以分离特定克隆以进行进一步表征。
编码抗CD19 CAR的pSFG逆转录病毒载体与人类IL15基因和使用2A 序列肽 (iC9.CAR19.CD28-zeta-2A-IL-15)分离的诱导型caspase-9 自杀基因相结合,之前已有描述 (6 , 7) 。
流式细胞术
uAPC用针对IL-21、CD48和4-1BB配体的抗体染色以检测和量化强制的转基因表达。
NK细胞分离
健康的人类外周血,通过密度梯度离心分离CB和外周血单核细胞(PBMC)。使用NK分离试剂盒纯化CD56阳性NK细胞,并用辐照(100 Gy)uAPC(饲养细胞与NK细胞的比例为2:1)和重组人IL-2在第0天在完全无血清干细胞生长培养基(SCGM)中。
在特定的比较实验中, uAPC被C9/IL-21取代,C9/IL-21是一种先前表征的饲养细胞,也含有mbIL21。在第+6天,在人纤连蛋白包被的板中用逆转录病毒上清液转导活化的NK细胞。三天后(第+9天),NK细胞再次用照射过的uAPC和IL-2刺激。在第+15天,收集CAR转导的NK细胞用于指定的测定。
NK细胞表型分析和功能分析
在离体培养的14-21天内评估NK细胞生长,并每3天使用台盼蓝排除法计算存活率。通过FACS评估NK细胞的CD48、IL-21、CD137L(4-1BBL)、CD14、CD45和CD32(以识别K562)的表达。CAR转导的CB-NK细胞用Alexa-Fluor647亲和纯化的F (ab’)2片段山羊抗人IgG (H+L)抗体CAR Ab染色CAR表达。
此外,还在培养的第14天使用离体扩增的非转导(NT)和iC9/CAR.19/IL-15 (CAR) NK细胞测量细胞内细胞因子。为了评估效应子功能,将NK细胞以 0.25×106个细胞/孔在96孔板中与Raji细胞或 K562 靶标(阳性对照)以效应子与肿瘤细胞的比率(E:T 比率)5:1共培养5小时。CD107a脱粒和细胞内细胞因子产生的测量如前所述(11)。
NK细胞细胞毒性试验
为了评估细胞毒性,将体外扩展研究或良好生产规范(GMP)级NT和 iC9/CAR.19/IL-15(CAR)转导的NK细胞与51Cr标记的Raji和K562靶标(阳性控制)在不同的E:T比率。通过51Cr的释放来测量细胞毒性。
小鼠异种移植模型
我们使用NOD/SCID IL-2Rγ无效(NSG)异种移植模型(9)和侵袭性NK抗性Raji 细胞系,评估CAR转导的CB-NK细胞的体内抗肿瘤作用。成年NSG小鼠(10-12周大)在第0天接受300cGyγ辐射,并在第0天静脉内接种用萤火虫荧光素酶(ffluc)转基因稳定转导的 Raji 细胞(2×104)。使用uAPC或C9/IL-21作为饲养细胞的新鲜扩增的CAR转导的CB-NK细胞,然后在第0天以3×106个细胞的剂量在200μL体积中通过尾静脉注射。小鼠每周接受一次生物发光成像。
RNA测序(RNA-Seq)
在第0天(基线)或扩增后15天,从 5×106 离体扩增的NT和iC9/CAR.19/IL-15 (CAR) 纯化的NK细胞中提取和纯化RNA uAPC。SmartSeq2 RNA-seq文库如(13)所述制备。使用Illumina HiSeq 2500 (16)合并索引文库并使用50 bp双端读取进行测序。
质谱流式细胞术
简而言之,在MD Anderson Cancer Center Flow and Mass Cytometry Core Facility使用来自Fluidigm的 MaxPar抗体标记试剂盒(目录#201300)用金属标签标记抗体。校准珠被门控,并根据铱193染色和事件长度选择单线态。死细胞被 Pt195通道排除,并进行进一步的门控以选择CD45+细胞,然后选择感兴趣的NK 细胞群(CD3-CD56+)。t-SNE分析是使用自动降维进行的,包括(viSNE)与FlowSOM结合用于静息NK细胞(未刺激,第0天)的聚类或与uAPC共培养14天(扩增的NK细胞)。
uAPC合规性验证和GMP使用
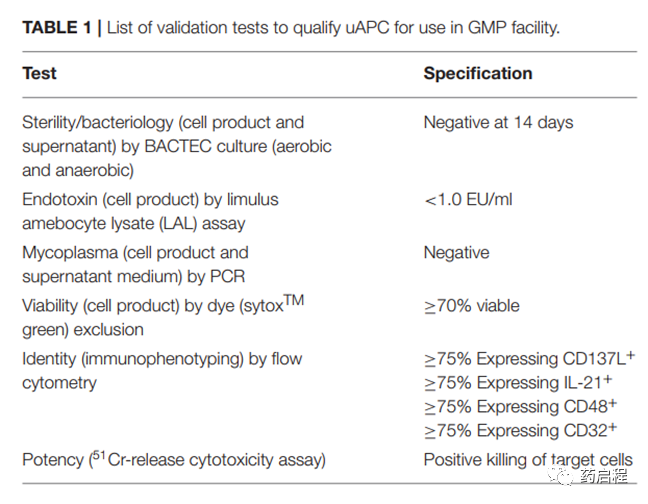
验证计划和程序是根据FDA指南(18, 19)制定的,以符合人类基因治疗研究新药申请(IND)的化学、制造和控制(CMC)信息要求,并控制关键过程,控制电池产品的安装、操作和性能资格(20)。通用和产品特定的特性以及阶段特定的要求都得到了保留。过程中和最终产品测试包括:无菌、内毒素、支原体(细胞收获时的PCR 测试)、活力、鉴别(通过流式细胞术识别特定细胞类型)和体外功能性杀伤。
使用uAPC进行GMP NK细胞扩增
使用G-Rex®生物反应器(美国明尼苏达州圣保罗)与uAPC共培养扩增NK细胞,用于CB-NK CAR临床试验(21)(NCT 编号:NCT03056339)。这种封闭的细胞培养系统可以使用带有透气膜的烧瓶,从而实现最佳的气体交换并确保有氧生长动力学。使用先前优化的变量,包括细胞接种密度、校准的培养基体积和培养基配方,我们能够从临床前协议中调整G-Rex M100系列,以在GMP设置中将程序转换和线性缩放到所需的产量。
端粒长度分析
CB-NK细胞中的端粒长度使用绝对人端粒长度定量qPCR检测试剂盒并按照制造商的说明通过定量PCR进行检测。
统计分析
均值标准误(SEM)用于比较CB NK细胞倍数扩增和效应子功能的差异。统计显着性确定为 p≤0.05。
试验结果
逆转录病毒转导共表达4-1BBL、CD48和膜结合IL-21的基于K562的饲养细胞的生成和优化
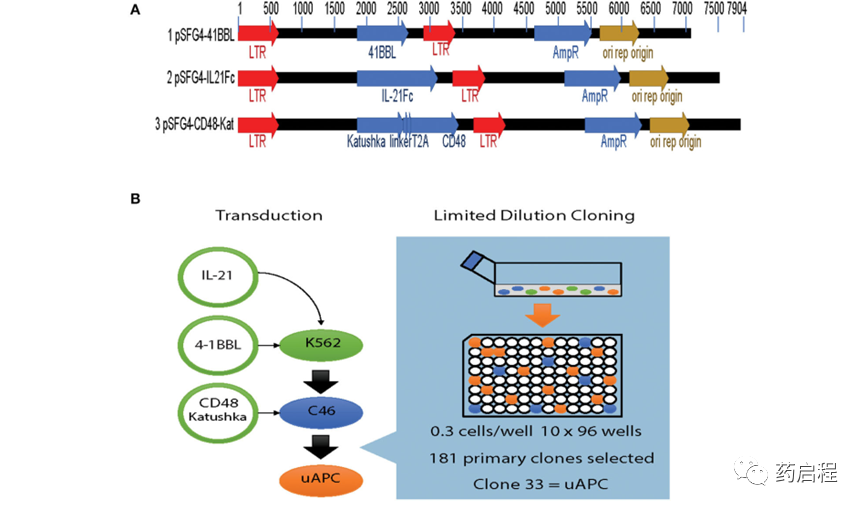
图 1. 基于K562的通用抗原呈递细胞 (uAPC) 的生成。
使用流式细胞术门控策略对亲本 K562、克隆 46 和 uAPC 细胞进行免疫表型分析,如图 2A 所示。简而言之,选择“髓样”门控细胞作为单细胞,并研究活细胞的 mbIL-21、4-1BBL(CD137L)和 CD48 表达(图 2B-D)。uAPC 中的 mbIL-21、4-1BBL 和 CD48 转导效率 >75%,并且在 300 天内保持稳定(图 2E)。CD32 用于确认 K562 细胞的身份。因此,这些数据证实了稳定共表达 mbIL-21、4-1BBL 和 CD48 的基于 K562 的 uAPC 细胞系的产生。我们还证实,我们基于基因工程 K562 的 uAPC 的倍增时间范围为 23.26 至 26.42 小时(n = 3 个独立实验),这与之前关于亲本 K562 和衍生细胞系的报告一致 (10)。
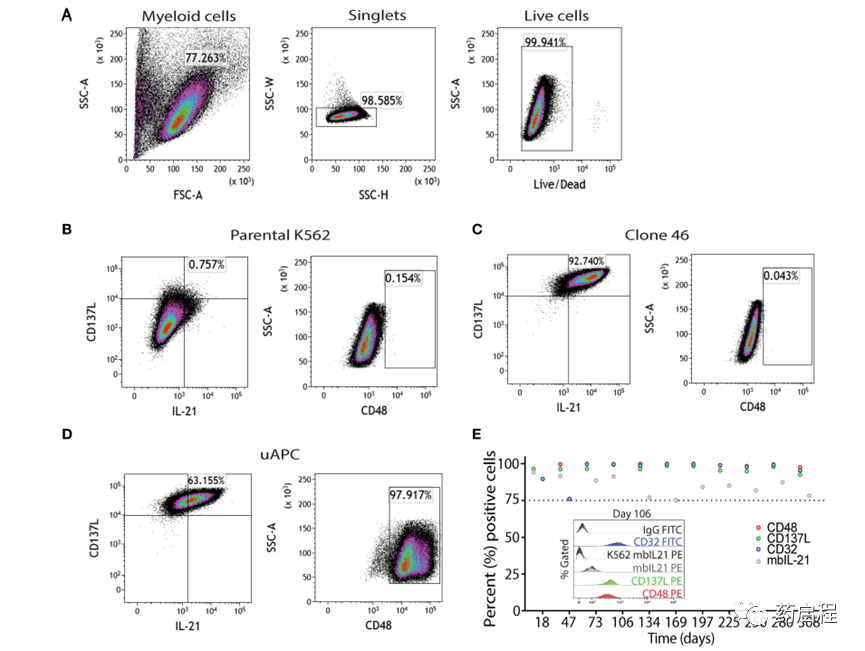
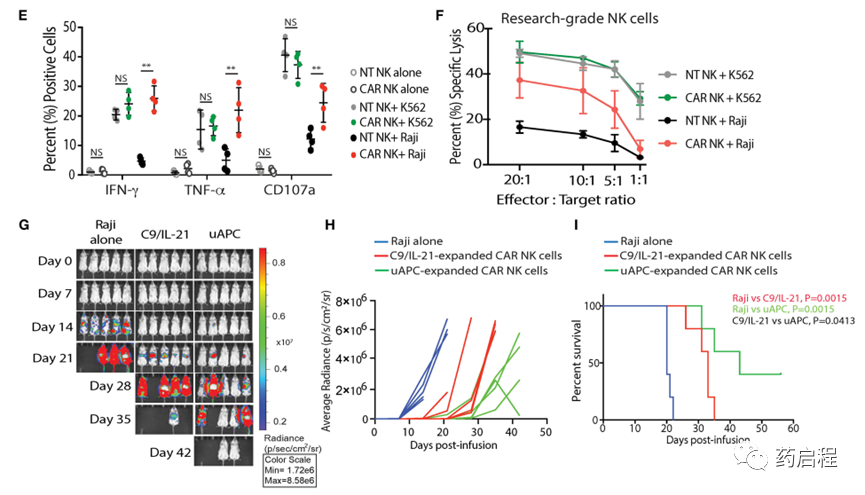
图 2. uAPC 的表型特征。
uAPC增强研究级装甲CAR-NK细胞的抗肿瘤活性
首先,我们测试了uAPC是否可以促进CB-NK细胞的体外扩增。在与uAPC共培养7天和14天后,我们观察到研究级NK细胞的9倍(中值=8.96,范围=8.26-10.1)和 903 倍扩增(中值=784,范围=752-1,174)(图 3A)。
重要的是,与uAPC共培养的非转导(NT)对照和iC9/CAR.19/IL-15(CAR转导)研究级NK细胞在第15天和第22天均表现出高NK细胞纯度(>97%)。通过流式细胞术确定与uAPC共培养(图 3B、C)。
此外,uAPC扩增的iC9/CAR.19/IL-15 (CAR)-NK细胞保留了它们的CAR表达(>85%)(图 3B、C),产生显着更高水平的IFN-γ和TNF-α,并显示与NT NK 细胞相比,对CD19+ Raji淋巴瘤细胞的更多脱颗粒(CD107a)和细胞毒性(图 3D-F)。CAR NK细胞在杀死CD19阴性K562靶标方面与NT NK细胞一样有效(图 3F),表明先天NK细胞杀伤机制在uAPC刺激后保持不变。我们还测试了uAPC支持NK细胞扩增超过14天的能力。NK细胞用uAPC+IL-2扩增1周。然后在每周存在或不存在每周uAPC饲养细胞的情况下收集细胞并与IL-2 (100 U/ml)一起长期培养。
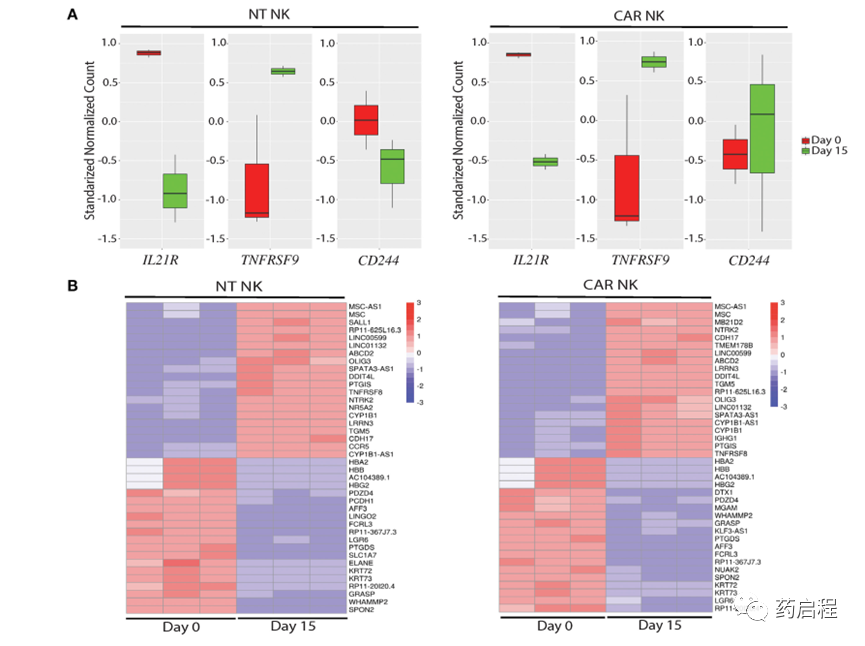
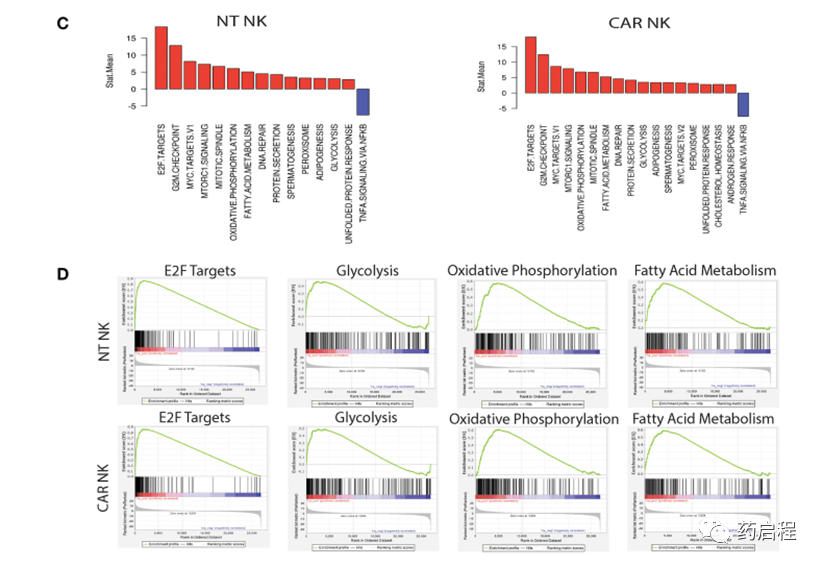
图 3. uAPC 促进研究级 NT 和 iC9/CAR19/IL-15 NK 细胞的增殖和细胞毒性。
此外,我们比较了用uAPC扩增的CAR转导的CB-NK细胞的端粒长度、体外和体内活性与先前报道的表达4-1BBL和mbIL21的K562衍生的APC (C9/IL-21) (15)。我们观察到在体外使用两种饲养细胞系产生的NK细胞的端粒长度(补充图 3)、倍数扩增或细胞毒性没有显着差异。重要的是,uAPC扩增的CAR-NK细胞在Raji异种移植小鼠模型中发挥了优异的体内抗肿瘤活性(图 3G-I)。在直接比较中,使用由同一CB供体产生的CAR-NK细胞,接受用uAPC扩增的CAR-NK细胞的小鼠实现了更好的肿瘤控制(图 3G、H)并且与用CAR治疗的动物相比存活时间明显更长(图 3I) – 用 C9/IL-21生成的NK细胞。总之,这些数据支持这样一种观点,即NK细胞激活的三信号模型能够使NK细胞稳健扩增并具有更强的抗肿瘤效力。
与uAPC刺激相关的NK细胞表型和分子特征
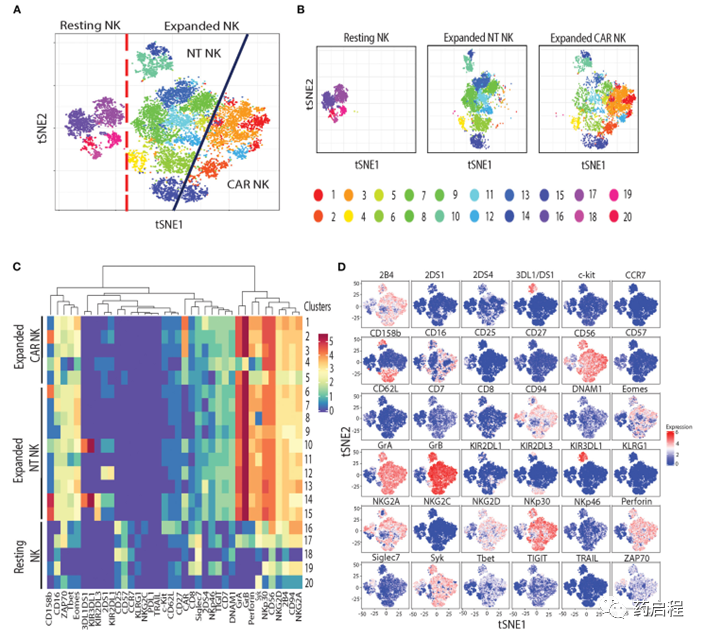
图 4. uAPC 扩增的 NT 和 iC9/CAR19/IL-15 NK 细胞的分子特征。
暴露于uAPC(第15天)后NT和CAR NK细胞的转录组学分析显示,与基线(第0天)相比,与效应子功能相关的基因上调。重要的是,我们没有观察到任何与疲劳、无反应性或衰老相关的途径(图 4B)。在uAPC刺激的NT和CAR NK细胞中,与细胞周期、细胞膜形态和代谢途径相关的基因同样增加(图 4C)。基因集富集分析(GSEA)揭示了uAPC激活的NT和CAR NK细胞中涉及 E2F 靶标、糖酵解、氧化磷酸化和脂肪酸代谢的基因的富集(图 4D)。特别值得注意的是,这些代谢动员模式与脂质生物发生和细胞膜重组相一致,表明了一个活跃的程序,表明细胞增殖以及NK细胞内效应器成分的启动以准备细胞毒性活动(24)。二维主成分分析 (PCA)的特征值截止值为1和2,可以通过其不同的状态轻松区分样品(补充图 6),进一步支持我们扩增的NK细胞的非克隆性质。
接下来,为了评估与NK细胞中uAPC扩增相关的表型变化,我们使用了飞行时间(CyToF)细胞术和一组36种针对抑制性和激活性受体的抗体,以及分化、归巢和激活标记物。我们鉴定了20个不同的NK细胞簇,它们表征静息、uAPC扩增的 NT和CAR NK细胞(图 5A、B)。
静息NK细胞主要由16-20簇组成,而簇 1-5 仅在扩增的CAR NK细胞中观察到,簇6-15由扩增的NT和CAR NK细胞共享(图 5A、B)。uAPC扩增的NT和CAR NK细胞均显示出激活和细胞毒性标志物的表达增加,包括颗粒酶A (GrA)、颗粒酶 B (GrB)、穿孔素;与静息NK细胞相比,转录因子(Eomes、T-bet)和激活受体(NKp30、NKG2D、2B4、CD94/NKG2C)(图 5C、D)。总之,这些数据表明uAPC培养增强了NT和CAR NK细胞的活化和抗肿瘤活性,同时保留了它们的CAR特异性。
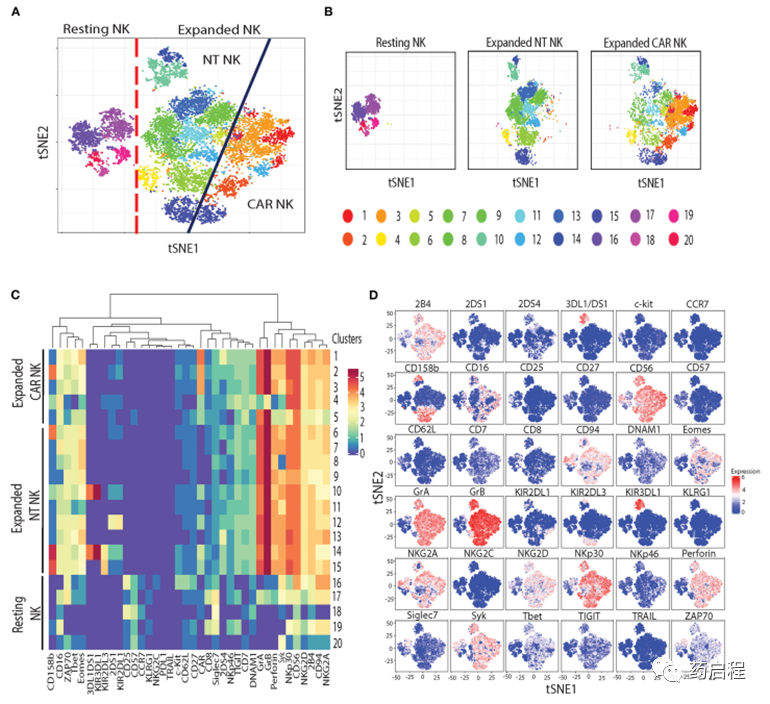
图 5. 静息与 uAPC 扩增 NK 细胞的表型特征。
用于cGMP的临床级uAPC的验证和表征
为了在cGMP环境中使用uAPC来生成基于NK细胞的治疗产品,我们根据当前的最佳实践基于发布标准进行了一系列验证运行。我们建立并分析了表 1 中列出的释放标准,包括无菌性、活力、特性和效力,如所示满足监管要求。此外,还建立了处理和使用uAPC以促进NK体外扩增用于临床生产的标准操作程序,以帮助质量保证和质量控制。作为我们确保uAPC在临床使用中的完整性的努力的一部分,我们还对uAPC进行了遗传指纹识别,并表明STR谱与K562亲本谱系相匹配。
在制定和建立GMP级uAPC的发布标准后,我们在GMP实验室验证和表征了NK细胞扩增过程。与在使用前按需生长和辐照的研究级uAPC批次相比,临床级uAPC批次会根据需要进行膨胀、辐照、冷冻保存和解冻以备使用。与研究级 CB NK细胞(图 3A)类似,GMP级CB NK细胞产品在与GMP级uAPC共培养后第14天和第21天显示出强劲的扩增(>1,000 倍)(图 6A)。重要的是,用GMP级uAPC 扩增的NT和 iC9/CAR.19/IL-15 (CAR) NK细胞具有出色的纯度,检测到低频率至零T细胞(0.01-0.04%)(图 6B、C)。在我们的临床NK细胞产品中,低T细胞污染是预防 GvHD 的必要条件。此外,扩增的细胞群是CD45+CD32-,表明没有uAPC细胞生长(图 6B、C)。与NT对照相比,使用GMP级uAPC刺激的iC9/CAR.19/IL-15 (CAR) NK细胞对Raji淋巴瘤细胞发挥更大的细胞毒性(图 6D),而uAPC刺激的NT和 iC9/CAR.19/IL -15 (CAR) NK细胞在杀死K562靶标方面同样有效(图 6D)。一旦临床级uAPC在GMP实验室得到验证,就建立了一个主细胞库,并在正在进行的I/II期临床试验中为我们获得了FDA的批准。
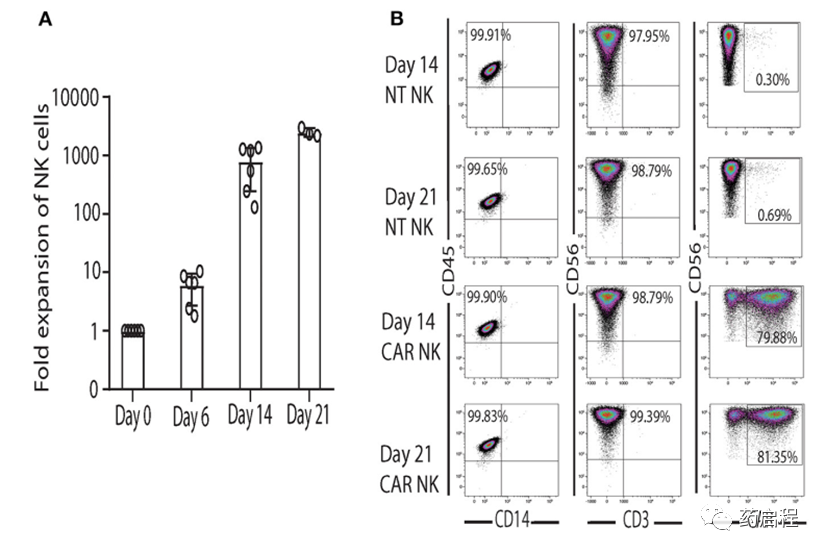
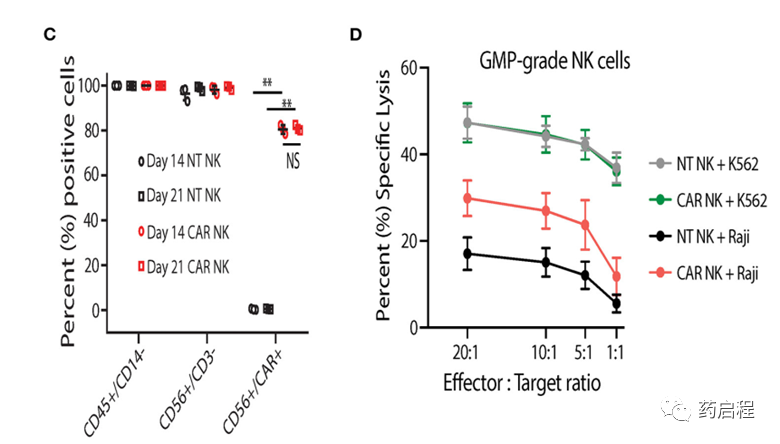
图 6. 与GMP级uAPC共培养的临床级NK细胞显示出强大的扩增和抗肿瘤活性。
讨论
在未经处理的脐带血或外周血单核细胞部分中发现的NK细胞数量相对较少,限制了NK细胞免疫疗法的治疗应用。因此,NK细胞的体外扩增已越来越多地用于产生临床相关剂量。
跨膜4-1BB是目前最常用的共刺激受体,可与CD80/86以及IL-2、IL-15和IL-21 的各种组合一起扩增NK细胞。我们的方法利用独特的SLAMF介导的NK细胞免疫雕刻来优化临床应用的产品。
我们的目标是确定一组最小的抗原刺激,足以在2-3周内触发研究和临床级NK细胞的最佳体外扩增。选择K562肿瘤细胞系作为刺激细胞,因为它们(1)大部分缺乏MHC决定簇,因此对NK细胞的细胞毒性敏感,(2)在悬浮培养中生长,易于与NK 细胞的相互作用,(3)具有相对18-24小时的短倍增时间和(4)很容易且稳定地被逆转录病毒转导,以根据需要强制表达抗原。
NK细胞中的“信号1”(39)没有已知或简单的替代品(例如T细胞中的TCR-MHC 相互作用)。NK细胞和靶细胞之间直接物理相互作用的启动极大地影响了NK细胞在杀死或保留靶细胞方面的反应。因此,我们建议由KIR识别uAPC上HLA I类缺失介导的“失踪自我”相互作用是NK细胞中“信号 1”反应的最接近替代物。为了诱导信号 2(辅助受体)引发的细胞相互作用,我们考虑使用来自同源免疫球蛋白受体的信号淋巴细胞激活分子(SLAM,以前也称为CD2超家族)的抗原,这些受体广泛表达并在免疫系统中发挥关键作用,具有细胞间相互作用的一个特别重要的特征。我们使用CD48作为uAPC中的替代“信号 2”来启动与NK细胞的细胞间相互作用。CD48 是一种存在于细胞表面的糖基磷脂酰肌醇锚定蛋白(GPI-AP),参与免疫细胞的粘附和激活途径。尽管缺乏细胞内结构域,CD48的刺激会诱导脂筏中信号因子的重排、Lck激酶活性和酪氨酸磷酸化。作为粘附和共刺激分子,CD48是2B4的反受体,2B4是NK细胞的重要激活剂(40)。
我们还使用4-1BB配体作为第二个“信号 2”来介导 NK 细胞增殖和分化。值得注意的是,4-1BB在我们在第15天收集uAPC刺激的 NK 细胞中显着上调(图 4A)。在活化的 NK 细胞中,CD137 是一种细胞因子诱导型共刺激分子,它反过来通过增加细胞增殖和 IFN-γ 分泌来驱动 NK 细胞的抗肿瘤反应。使用 CD137L-/- 基因敲除小鼠的研究表明 CD137/CD137L 信号轴在抗肿瘤免疫细胞发育中的重要性。CD137 在调节 NK 细胞介导的抗肿瘤作用中的关键作用在 CD137-/- 基因敲除小鼠中很明显,与对照小鼠相比,这些小鼠的肿瘤转移频率高 4 倍。4-1BB 配体(4-1BBL、CD137L)形成同源三聚体胞外域,具有独特的三叶螺旋桨构象 (41),不同于肿瘤坏死因子 (TNF) 超家族其他成员形成的三聚体,暗示功能性分子信号的差异 (42)。虽然可以用抗4-1BB抗体刺激NK细胞上的4-1BB,但我们选择了4-1BB 配体 (41BBL),CD137的生理反受体,以获得最佳刺激。
细胞因子信号传导对于维持淋巴细胞存活、增殖和效应器功效也至关重要。体内IL-2给药 FDA批准的用于在患者体内扩增免疫细胞的唯一方法。认识到细胞因子刺激对 NK细胞健康的重要性,我们的“信号 3”策略是将mbIL-21封装为 uAPC 的一部分。对于基因工程化以表达CAR的NK细胞,我们编码了一个用于组成型自分泌分泌的IL-15表达盒 (9)。
虽然我们注意到与uAPC孵育后NT和CAR NK细胞中IL-21R(图 4A)的下调,但这种观察的机制仍有待确定。能量学(糖酵解、氧化磷酸化和脂肪酸代谢)和脂质生物发生基因的动员符合增殖NK细胞的代谢特征(44)。重要的是,缺乏与衰竭、无反应或衰老相关的生物标志物(图 4B)支持我们生产准备靶向癌症的NK细胞的目标。此外,通过质谱流式细胞术对NK细胞的表型分析(图 5)产生了独特的静息和激活 NK 细胞群,表明非克隆扩增。
总之,我们的适应性强且强大的 uAPC 平台不是仅仅依赖商业供应商提供关键生物试剂,这可能导致不可预测和有害的供应链中断,而是在一个紧凑的包装中提供必要和预期的 NK 细胞刺激,以供持续临床使用。


D
O
i
:
GMP-Compliant Universal Antigen Presenting Cells (uAPC) Promote the Metabolic Fitness and Antitumor Activity of Armored Cord Blood CAR-NK Cells
doi: 10.3389/fimmu.2021.626098
编辑:小果果,转载请注明出处:https://www.cells88.com/linchuang/lcyj/9275.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫