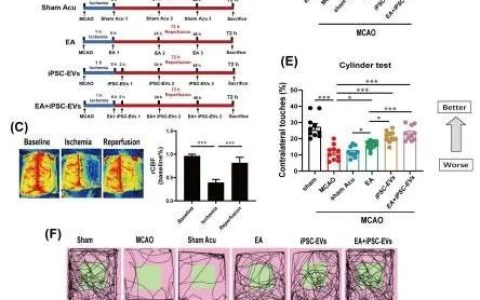
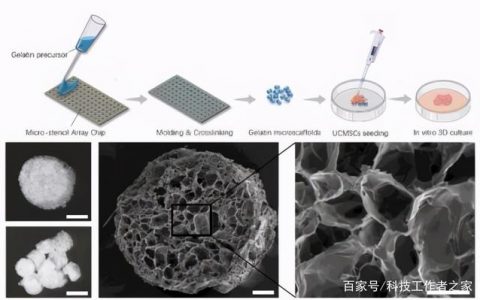
一、研究目的:改进型CAR-T细胞治疗B细胞淋巴瘤的单中心、单臂、非盲安全性及有效性临床研究
研究疾病:B细胞淋巴瘤
二、天津市第一中心医院

伦理委员会:天津市第一中心医院临床科研项目伦理委员会
试验设计:单臂
三、入职标准:
2)14-80岁B细胞淋巴瘤患者(无边界值);
3)符合难治性和复发性B细胞淋巴瘤的临床标准。难治性的定义包括:对最近治疗无反应(对最近治疗的最新反应是PD;对最近治疗的最新反应是SD,维持时间不超过6个月);不适合或不愿意接受自体干细胞移植,或对ASCT难治。受试者之前已经过充分治疗,治疗史至少包括:抗CD20单克隆抗体(利妥昔单抗),除非研究者确定肿瘤为CD20阴性;含有蒽环类药物的化疗方案;根据修订IWG的恶性淋巴疗效评估标准(2007年版),在基线期间至少有一个可测量的病变;
4)预期生存时间为≥12周;
5)ECOG(东部肿瘤学组)基线评分为0或1;
6)足够的器官功能:
肾功能定义为:血浆肌酐≤正常上限的1.5倍,或估计肾小球滤过率(eGFR)≥60ml / min / 173m2;
肝功能定义为:ALT患者≤与年龄相对应的正常值上限的5倍,胆红素患者≤2.0mg /dl,Gilbert-Meulengracht综合征患者除外。吉尔伯特 – 梅伦格拉赫特综合征患者胆红素≤正常上限的3.0倍,直接胆红素≤正常上限的1.5倍;
7)稳定的血流动力学和左心室射血分数(LVEF)≥超声心动图或多通道放射性核素血管造影(MUGA)确定;
8)不输血的充足骨髓储备,定义为:中性粒细胞绝对计数(ANC)>1.000/mm3;绝对淋巴细胞计数(ALC)≥300 /mm3;血小板≥50.000 /mm3;血红蛋白>8.0克/分升;
9)必须有非动员性血液分离术或外周血收集细胞用于CAR-T细胞的产生;
10)使用下列药物的患者应符合以下条件:
类固醇:类固醇的治疗剂量必须在CAR-T输注前1周停止。然而,允许生理替代剂量的类固醇;
免疫抑制:任何免疫抑制药物必须在选择前2周≥停药;
输注前两周内除淋巴消耗性化疗以外的抗增殖治疗;
CD20抗体相关治疗必须在输注前2周或5个半衰期(以较长者为准)内停止;
必须在CAR-T输注前1周停止预防中枢神经系统疾病(如鞘内注射甲氨蝶呤);
11)育龄女性和所有男性受试者必须同意在CAR-T输注后至少12个月内使用高效避孕方法,直到连续2次PCR测试显示体内没有CAR-T细胞。
四、排除标准
1)目前患有或有中枢神经系统疾病史的患者,如癫痫发作,脑血管缺血/出血,痴呆,小脑疾病或任何涉及中枢神经系统的自身免疫性疾病;
2)在CAR-T输注前2周内接受过淋巴细胞耗竭化疗以外的化疗的患者;
3)对2周内接受过其他研究药物治疗的患者进行筛查;
4)输液前1周内接受放疗的患者;
5)活动性乙型肝炎(定义为乙型肝炎病毒DNA检测值>500 IU / mL)或丙型肝炎(HCV RNA阳性)的患者;
6)HIV阳性或梅毒螺旋体阳性患者;
7)患有急性和危及生命的细菌,病毒或真菌感染的患者,这些感染尚未得到控制(例如,输注前72小时血培养阳性≤);
8)筛查前6个月内出现不稳定型心绞痛和/或心肌梗死的患者;
9)同时患有其他未治愈恶性肿瘤的患者;
10)孕妇或哺乳期女性患者;
11)未得到医疗管理控制的心律失常患者;
12)CAR-T细胞输注前1周内接受口服抗凝治疗的患者;
13)患有活动性神经性自身免疫性疾病或炎症性疾病(如吉良-巴利综合征、肌萎缩性侧索硬化症);
14)研究者认为不应参加本临床试验的其他情况,如依从性差。
五、研究时间:2021年11月1日至2023年11月1日
六、研究负责人 赵明峰
研究负责人电子邮件:mingfengzhao@sina.com

1997年考入中国医学科学院、中国协和医科大学,从事血液病临床及基础研究,2002年获得临床医学博士学位。2002年10月至2003年10月在美国国立卫生研究院(NIH)做博士后访问学者,从事血液干细胞基因治疗的研究。2003年10月至2005年4月在美国杜克大学医学中心(Duke University Medical Center)做博士后访问学者、副研究员,从事血液肿瘤的免疫治疗及细胞信号传导调节研究。
编辑:小果果,转载请注明出处:https://www.cells88.com/linchuang/lcyj/8140.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫