CAR-T细胞疗法自诞生以来就被寄予厚望,近几年其在血液肿瘤治疗领域大放异彩。然而,这一突破性细胞免疫疗法同样存在缺陷,由于受到肿瘤微环境和T细胞耗竭等因素影响,CAR-T在实体瘤治疗领域的应用无法令人满意。为加速CAR-T在实体瘤领域的临床转化,不少研究开发了限制和抗耗竭T细胞的方法,为CAR-T治疗实体瘤提供了一些新策略。
近年来,已有多项研究表明多种转录因子参与调控T细胞耗竭过程,如BATF、TOX,NR4A,c-jun等。其中,转录因子BATF在T细胞耗竭中的作用颇有争议。一方面,有研究称PD-1通过上调BATF的表达而导致T细胞耗竭,也有研究表明CAR-T细胞敲除BATF提高了效应因子IL-2及IFNγ的分泌;而另一方面,有研究发现BATF的缺失降低了T细胞分泌IFNγ及增殖的能力,同时,也有研究认为BATF可以阻断CAR-T细胞的耗竭,过表达BATF使CAR-T细胞具有更强的增值能力和肿瘤杀伤能力,并产生长期的肿瘤抑制效果。
而在今年10月7日,由中国科学院动物研究所、干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王皓毅团队在Cancer Cell 期刊发表的一篇题为:Depletion of BATF in CAR-T cells enhances antitumor activity by inducing resistance against exhaustion and formation of central memory cells 的研究论文中,发现转录因子BATF在CAR-T细胞耗竭过程中发挥着重要作用,敲除BATF可以提高CAR-T细胞的抗耗竭能力及形成中央记忆细胞的能力,从而产生持久有效的抗肿瘤效果。
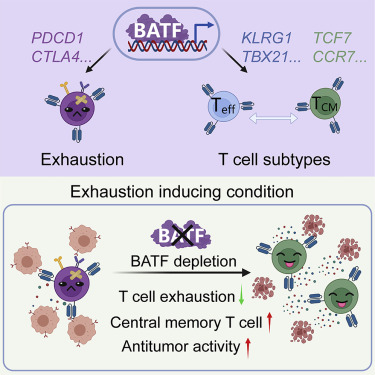 ▲ 图片来源:eLifeBATF在CAR-T细胞耗竭诱导条件下的功能 (图片来源:参考资料1)
在这项研究中,研究人员建立了一个体外CAR-T细胞功能缺陷模型,并通过使用该模型进行候选基因筛选,发现敲除转录因子BATF可以显著提高CAR-T细胞的体内、外抗肿瘤活性。
为了进一步验证BATF的功能,该团队通过在人的6种不同CAR-T细胞及小鼠的OT-1 T细胞中进行BATF的敲除和过表达。研究发现,在不同耗竭诱导的条件下,BATF敲除均可以提高CAR-T/OT-1 T细胞抗肿瘤活性,而BATF过表达则降低了CAR-T/OT-1 T细胞的杀伤能力。未来,在临床应用中使用BATF缺失的CAR-T细胞具有持久性和有效性优势。
值得一提的是,早在2019年,拉霍亚免疫学研究所(LJI)的科学家发表在Nature杂志上的一项研究同样表明,一种名为Nr4a的转录因子蛋白质家族在调节与T细胞衰竭相关基因方面发挥着重要作用。通过小鼠模型,科学家们证明,用缺乏这些Nr4a转录因子的CAR-T细胞治疗小鼠,可以使肿瘤变小,存活率更高。
▲ 图片来源:eLifeBATF在CAR-T细胞耗竭诱导条件下的功能 (图片来源:参考资料1)
在这项研究中,研究人员建立了一个体外CAR-T细胞功能缺陷模型,并通过使用该模型进行候选基因筛选,发现敲除转录因子BATF可以显著提高CAR-T细胞的体内、外抗肿瘤活性。
为了进一步验证BATF的功能,该团队通过在人的6种不同CAR-T细胞及小鼠的OT-1 T细胞中进行BATF的敲除和过表达。研究发现,在不同耗竭诱导的条件下,BATF敲除均可以提高CAR-T/OT-1 T细胞抗肿瘤活性,而BATF过表达则降低了CAR-T/OT-1 T细胞的杀伤能力。未来,在临床应用中使用BATF缺失的CAR-T细胞具有持久性和有效性优势。
值得一提的是,早在2019年,拉霍亚免疫学研究所(LJI)的科学家发表在Nature杂志上的一项研究同样表明,一种名为Nr4a的转录因子蛋白质家族在调节与T细胞衰竭相关基因方面发挥着重要作用。通过小鼠模型,科学家们证明,用缺乏这些Nr4a转录因子的CAR-T细胞治疗小鼠,可以使肿瘤变小,存活率更高。
实体瘤治疗中,PD-L1的表达可能是CAR-T细胞疗效不佳的原因。为了将PD-L1的抑制信号转化为刺激信号,有多个研究组在CAR-T细胞中共同表达靶向PD-L1的嵌合开关受体(CSRs),并发现这些CSRs增强了CAR-T细胞的抗肿瘤效应。
10月13日,中国科学院广州生物医药与健康研究所李鹏团队在Nature Communications上发表的题为“Co-expression of a PD-L1-specific chimeric switch receptor augments the efficacy and persistence of CAR T cells via the CD70-CD27 axis”的一项研究论文中,该科研团队设计了靶向PD-L1的CSR分子CARP,其不含CD3ζ链,因而CARP-T细胞不具有肿瘤杀伤活性。此项研究在体外和肿瘤人源化小鼠模型中证明了CARP-T细胞能够提升CAR-T细胞的抗肿瘤活性,促进中枢记忆样CAR-T细胞的分化,同时降低CAR-T细胞IL5、IL10和IL13等Th2型细胞因子的分泌。
相关机制研究发现,CARP分子能够反式结合激活CAR-T细胞表面的PD-L1,导致CARP-T细胞与CAR-T细胞间发生连接。单细胞RNA测序发现,CARP-T细胞与CAR-T细胞间的连接促进两种细胞间CD70与CD27分子的相互作用,而CD70-CD27信号通路进一步促进中枢记忆样CAR-T细胞的分化、降低Th2类细胞因子的分泌,最终提升了CAR-T细胞的抗肿瘤活性。
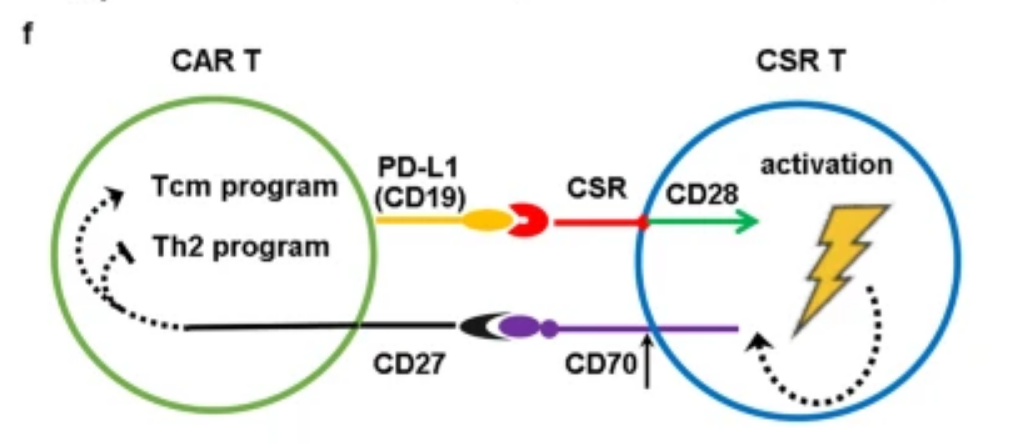 ▲ CSR -T和CAR-T细胞相互作用(图片来源:参考资料2)
此外,研究发现,此类细胞间作用不局限于靶向PD-L1的CSR-T细胞,且靶向CD19的CSR-T细胞同样能够提升共表达CD19分子CAR-T细胞的抗肿瘤活性。研究表明,CSR分子反式结合CAR-T细胞表面靶抗原后可通过CD70-CD27信号通路提升CAR-T细胞的疗效和持久性。目前,该研究处于基础研究阶段。
▲ CSR -T和CAR-T细胞相互作用(图片来源:参考资料2)
此外,研究发现,此类细胞间作用不局限于靶向PD-L1的CSR-T细胞,且靶向CD19的CSR-T细胞同样能够提升共表达CD19分子CAR-T细胞的抗肿瘤活性。研究表明,CSR分子反式结合CAR-T细胞表面靶抗原后可通过CD70-CD27信号通路提升CAR-T细胞的疗效和持久性。目前,该研究处于基础研究阶段。
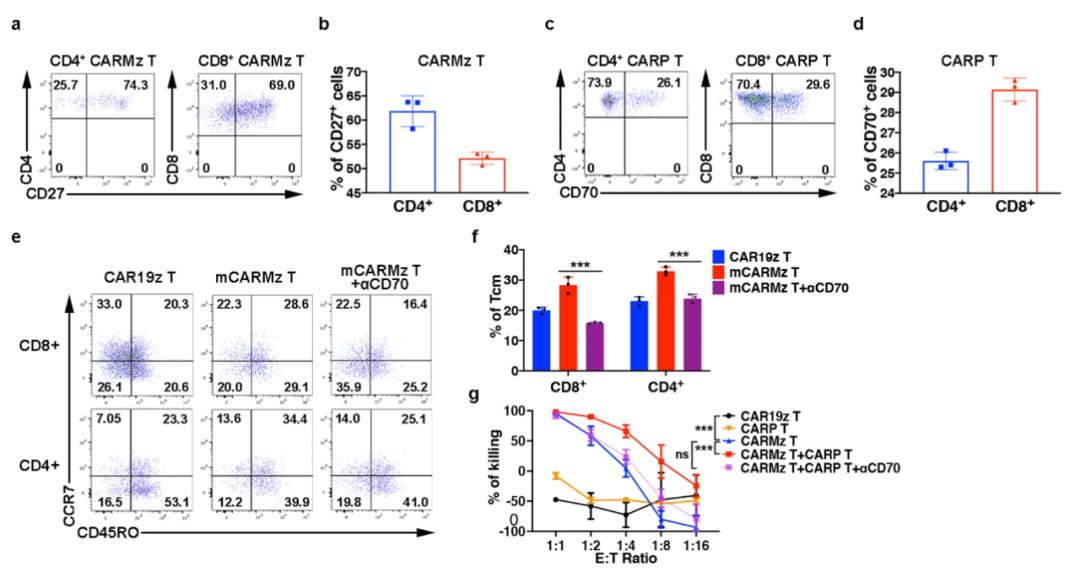 ▲CARP T细胞通过CD70-CD27增强CARMz T细胞的功效和持久性(图片来源:参考资料2)
▲CARP T细胞通过CD70-CD27增强CARMz T细胞的功效和持久性(图片来源:参考资料2)
三、构建双靶点嵌合抗原体系
在今年6月,李鹏课题组与暨南大学李扬秋课题组合作,在Molecular Therapy – Oncolytics上发表了题为“DAP10 integration in CAR-T cells enhances the killing of heterogeneous tumors by harnessing endogenous NKG2D”的研究。该研究设计了一种串联DAP10的嵌合分子。该嵌合分子可利用T细胞上的天然NKG2D受体靶向表达NKG2D配体的肿瘤细胞;之后将其与抗GPC3单链可变片段(scFv)串联,构建双靶点嵌合抗原体系,发现表达串联GPC3-DAP10嵌合受体的T细胞表现出双抗原靶向作用,在体内外可明显抑制异质性肿瘤细胞生长。
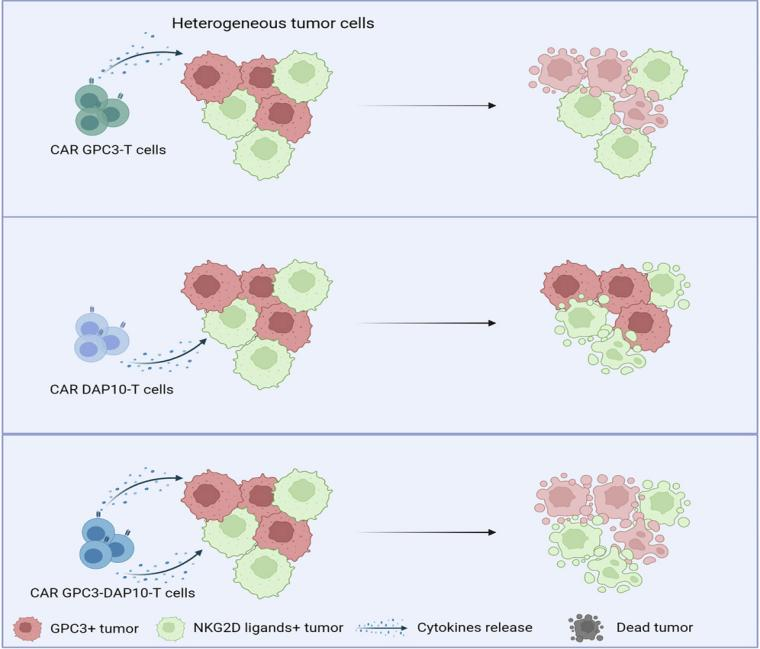 ▲ 图片来源:参考资料3
▲ 图片来源:参考资料3
四、免疫检查点和癌症治疗靶点抑制/敲除
2022年3月,澳大利亚莫纳什大学的研究人员在 Cancer Discovery 期刊发表了题为:PTP1B Is an Intracellular Checkpoint that Limits T-cell and CAR T-cell Antitumor Immunity 的研究论文。该研究将蛋白酪氨酸磷酸酶1B(PTP1B)确定为细胞内免疫检查点和癌症治疗靶点,PTP1B在肿瘤内T细胞中高表达,缺失或抑制PTP1B可增强T细胞抗肿瘤活性并增加CAR-T细胞对抗实体瘤的有效性。
在此项研究中,研究团队在小鼠模型中进行了验证试验,发现抑制PTP1B,能够增强癌细胞对PD-1抑制剂的反应。具体来说,T细胞特异性的PTP1B缺失或抑制增加了STAT5信号传导,这增强了抗原诱导的CD8+T细胞的扩增和细胞毒性作用,从而实现对肿瘤生长的抑制。更重要的是,PTP1B的缺失或抑制可以显著增强CAR-T细胞杀伤实体瘤(包括乳腺癌)的能力,这为CAR-T细胞疗法治疗实体瘤提出了新的方法。
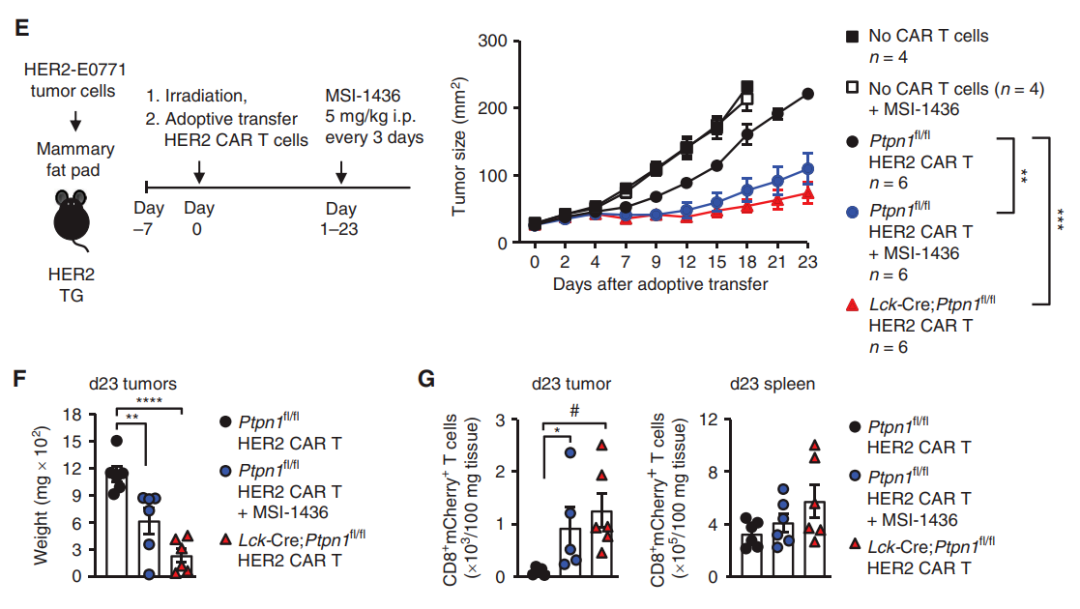 ▲ 抑制PTP1B可增强CAR-T细胞治疗有效性(图片来源:参考资料4)
▲ 抑制PTP1B可增强CAR-T细胞治疗有效性(图片来源:参考资料4)
同样,2022年10月,在Nature杂志上发表的一项题为“RASA2 ablation in T cells boosts antigen sensitivity and long-term function”的研究论文中,研究人员借助基于CRISPR的筛选文库确定了一种预防T细胞功能障碍的靶点基因——RASA2。并利用CRISPR基因编辑技术,对T细胞进行了基因改造,创建了RASA2基因敲除的T细胞。通过将这些T细胞反复暴露于癌细胞以及肿瘤微环境模型中,对其进行各种“应激测试”。发现这种新设计的T细胞对抗原具有更高的敏感性,击杀效率比传统的T细胞更高,并且能够存活更长的时间,持久地发挥抗肿瘤作用。
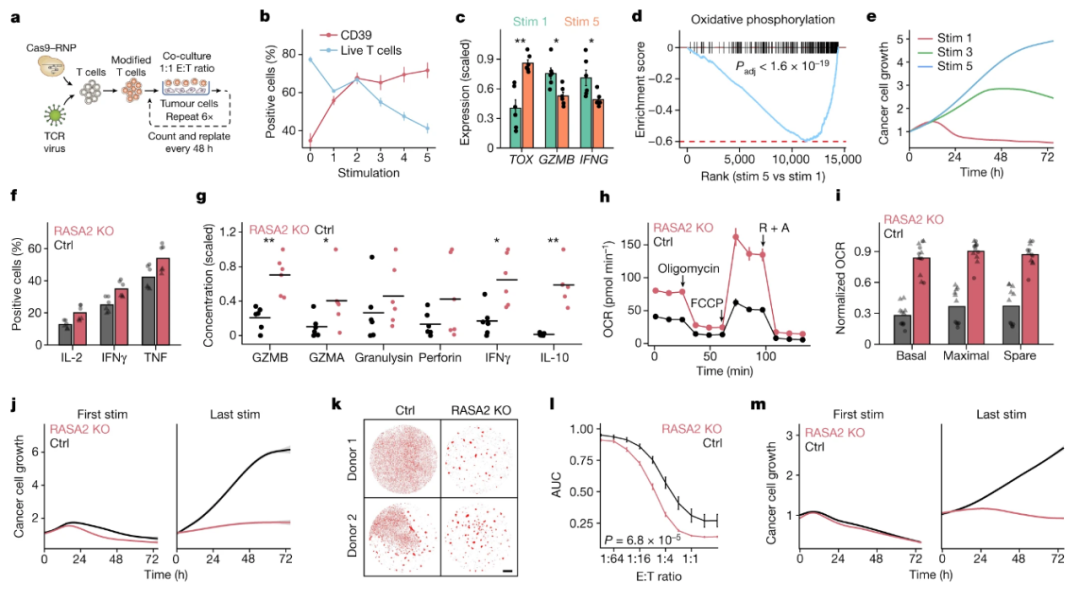 ▲ RASA2敲除改善了功能性T细胞的效力持久性 (图片来源:参考资料5)
▲ RASA2敲除改善了功能性T细胞的效力持久性 (图片来源:参考资料5)
此外,在2020年,一篇由宇繁生物首席科学官廖学斌与中山大学魏来发表在Cancer Cell 的研究论文中,证明了潜在的癌症免疫治疗靶点造血祖细胞激酶1(HPK1)的表达水平与患者肿瘤浸润T细胞衰竭正相关性,以及HPK1表达与癌症患者较差生存率之间的负相关性。该研究也阐明了HPK1是调控CAR-T细胞疗效的关键激酶,HPK1由基因MAP4K1编码。
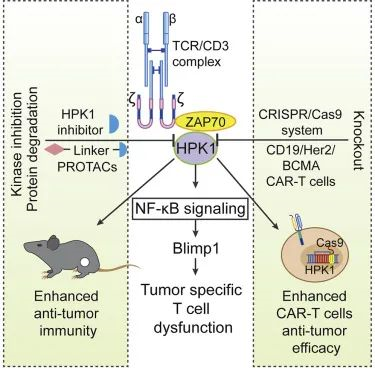 ▲ HPK1机制意图(图片来源:参考资料6)
▲ HPK1机制意图(图片来源:参考资料6)
研究团队探讨了HPK1对CAR-T细胞功能的调控,在CD19+,Her2+及BCMA+肿瘤模型中发现与WT或PD-1敲除的CAR-T细胞相比,MAP4K1敲除的CAR-T细胞具有更强的抗肿瘤效应:细胞耗竭程度降低、更低的毒性、更长的持续性、增加的浸润性。
五、细胞因子助力CAR-T
2022年6月,T细胞治疗公司NeoImmuneTech在Nature Communications杂志上发表的一项将长效人源细胞因子IL-7(NT-I7 )与针对 CD19 + B细胞淋巴瘤和急性髓性白血病的嵌合抗原受体 (CAR) T 细胞联合使用的体内研究结果中指出,NT-I7显著增加了 CAR-T 细胞的扩增和持久性。NT-I7(efineptakin alfa)是该公司的主要候选药物。
此项研究利用B细胞淋巴瘤或急性髓系白血病的复杂模型,以及急性早幼粒细胞白血病的免疫活性同源模型,以研究NT-I7对体内CAR-T细胞扩增和抗肿瘤反应的影响。最终结果表明,NT-I7增强了CAR-T疗法对急性髓性白血病和B细胞淋巴瘤的疗效,显著延长了小鼠模型的生存期,并显著增加了CAR-T细胞的扩增和持久性,使输注时所需的CAR-T细胞最少数量减少至少五倍。这些令人信服的数据证明NT-I7通过促进CAR-T抗肿瘤活性、扩展和持久性,有可能增强CAR-T治疗血液病的疗效。
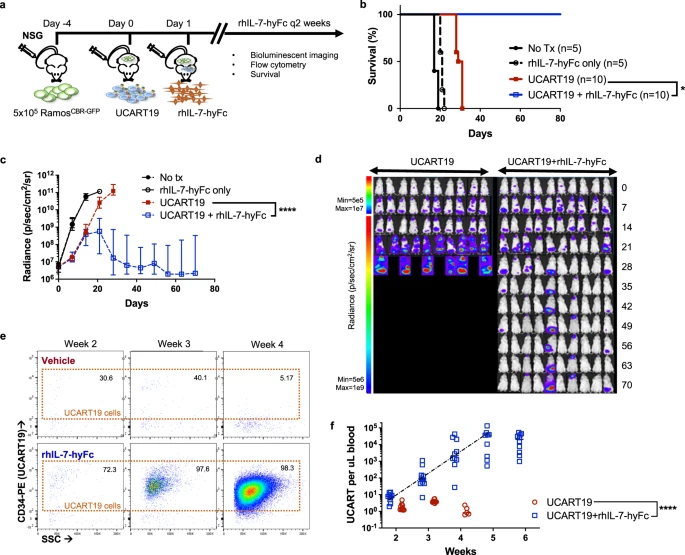 ▲ 在小鼠体内显著增强UCART19 的扩增、持久性和抗肿瘤功效(图片来源:参考资料7)
2021年,根据发表在Science Immunology上的研究结果,居里研究所的科学家团队在小鼠模型中采用全基因组CRISPR-Cas9筛选,将蛋白质SOCS1确定为抑制CD4+ T细胞增殖和存活的重要“刹车”。SOCS1确定通过在IFN-γ和IL-2信号传导下游起作用的因素,以抑制CD4 +的关键节T细胞增殖、存活和效应子功能。
研究人员通过在患有膀胱肿瘤的小鼠进行测试,用抗肿瘤活性CD4+T细胞以及SOCS1失活的T细胞对其进行治疗后发现,SOCS1缺失的T细胞比对照细胞更有效地浸润肿瘤近十倍。
此外,SOCS1在调节CD8+T细胞方面也发挥着作用。在患有黑色素瘤的小鼠模型中观察到,与对照T细胞相比,敲除了SOCS1的肿瘤特异性CD8+T细胞对肿瘤产生了显著且持久抑制作用。研究团队发现,在进入肿瘤的敲除了SOCS1的T细胞中,有更多数量的细胞毒性分子和效应T细胞,这可能解释了其强大的抗肿瘤作用的原因。
尽管当下CAR-T细胞治疗取得了显著进展,但CAR-T细胞在患者体内的有限持久性依然是一个挑战。而为了进一步扩大CAR-T细胞的临床应用,一些制药企业也在积极探索与尝试增加其CAR-T候选产品的持久性的方法,如通过CAR结构的优化、CAR-T中装载溶瘤病毒等等。虽然迄今为止的结果仍然有限,但近几年与之相关研究越来越多,基于以上各类研究,也或将为各大药企带来一些新的启示。相信不久的将来,终将会突破这一瓶颈,使CAR-T细胞疗法更广泛应用于实体瘤患者。
▲ 在小鼠体内显著增强UCART19 的扩增、持久性和抗肿瘤功效(图片来源:参考资料7)
2021年,根据发表在Science Immunology上的研究结果,居里研究所的科学家团队在小鼠模型中采用全基因组CRISPR-Cas9筛选,将蛋白质SOCS1确定为抑制CD4+ T细胞增殖和存活的重要“刹车”。SOCS1确定通过在IFN-γ和IL-2信号传导下游起作用的因素,以抑制CD4 +的关键节T细胞增殖、存活和效应子功能。
研究人员通过在患有膀胱肿瘤的小鼠进行测试,用抗肿瘤活性CD4+T细胞以及SOCS1失活的T细胞对其进行治疗后发现,SOCS1缺失的T细胞比对照细胞更有效地浸润肿瘤近十倍。
此外,SOCS1在调节CD8+T细胞方面也发挥着作用。在患有黑色素瘤的小鼠模型中观察到,与对照T细胞相比,敲除了SOCS1的肿瘤特异性CD8+T细胞对肿瘤产生了显著且持久抑制作用。研究团队发现,在进入肿瘤的敲除了SOCS1的T细胞中,有更多数量的细胞毒性分子和效应T细胞,这可能解释了其强大的抗肿瘤作用的原因。
尽管当下CAR-T细胞治疗取得了显著进展,但CAR-T细胞在患者体内的有限持久性依然是一个挑战。而为了进一步扩大CAR-T细胞的临床应用,一些制药企业也在积极探索与尝试增加其CAR-T候选产品的持久性的方法,如通过CAR结构的优化、CAR-T中装载溶瘤病毒等等。虽然迄今为止的结果仍然有限,但近几年与之相关研究越来越多,基于以上各类研究,也或将为各大药企带来一些新的启示。相信不久的将来,终将会突破这一瓶颈,使CAR-T细胞疗法更广泛应用于实体瘤患者。
参考资料:
1.Depletion of BATF in CAR-T cells enhances antitumor activity by inducing resistance against exhaustion and formation of central memory cells
2.Co-expression of a PD-L1-specific chimeric switch receptor augments the efficacy and persistence of CAR T cells via the CD70-CD27 axis
3.DAP10 integration in CAR-T cells enhances the killing of heterogeneous tumors by harnessing endogenous NKG2D
4.PTP1B Is an Intracellular Checkpoint that Limits T-cell and CAR T-cell Antitumor Immunity
5.RASA2 ablation in T cells boosts antigen sensitivity and long-term function
6.Hematopoietic Progenitor Kinase1 (HPK1) Mediates TCell Dysfunction and Is a Druggable Target for T Cell-Based Immunotherapies
7.Along-acting interleukin-7,rhIL-7-hyFc, enhances CART cell expansion, persistence, and anti-tumor activity
编辑:小果果,转载请注明出处:https://www.cells88.com/linchuang/lcyj/21129.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。
 ▲ 图片来源:eLifeBATF在CAR-T细胞耗竭诱导条件下的功能 (图片来源:参考资料1)
▲ 图片来源:eLifeBATF在CAR-T细胞耗竭诱导条件下的功能 (图片来源:参考资料1)
 ▲ CSR -T和CAR-T细胞相互作用(图片来源:参考资料2)
▲ CSR -T和CAR-T细胞相互作用(图片来源:参考资料2) ▲CARP T细胞通过CD70-CD27增强CARMz T细胞的功效和持久性(图片来源:参考资料2)
▲CARP T细胞通过CD70-CD27增强CARMz T细胞的功效和持久性(图片来源:参考资料2) ▲ 图片来源:参考资料3
▲ 图片来源:参考资料3 ▲ 抑制PTP1B可增强CAR-T细胞治疗有效性(图片来源:参考资料4)
▲ 抑制PTP1B可增强CAR-T细胞治疗有效性(图片来源:参考资料4) ▲ RASA2敲除改善了功能性T细胞的效力持久性 (图片来源:参考资料5)
▲ RASA2敲除改善了功能性T细胞的效力持久性 (图片来源:参考资料5) ▲ 在小鼠体内显著增强UCART19 的扩增、持久性和抗肿瘤功效(图片来源:参考资料7)
▲ 在小鼠体内显著增强UCART19 的扩增、持久性和抗肿瘤功效(图片来源:参考资料7)



 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫