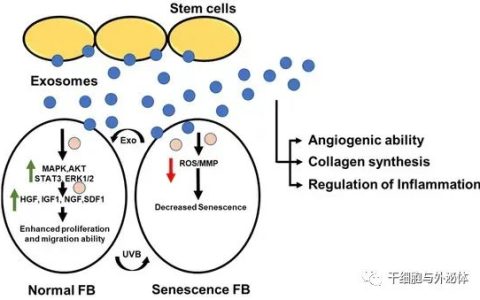
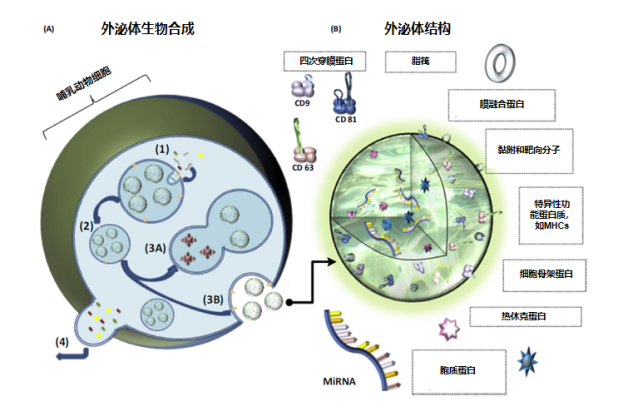
图 1 外泌体的生物来源过程和结构
–01–
外泌体的概念
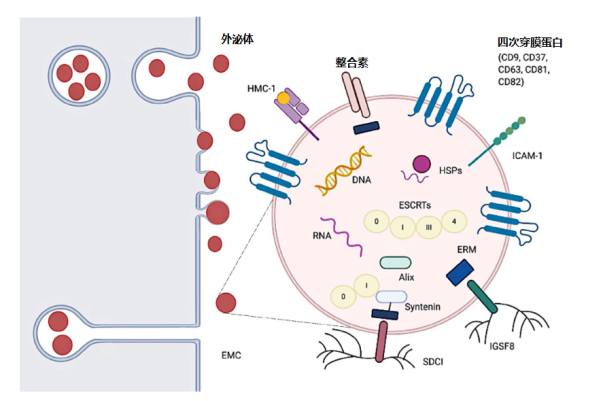
图 2 外泌体从核内体和质膜中萌发
-02-
外泌体的提取
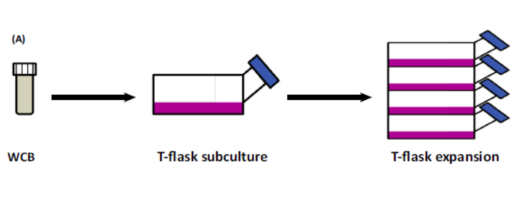
所有的细胞都可以分泌外泌体,机体的体液内和间质中均含有大量的外泌体。由于生物体内所含有的细胞或者蛋白非常丰富,因此从体内提取外泌体是非常困难的,而且外泌体来源的细胞也无法确定。
近年来,来自干细胞的外泌体引起了科学家们的关注。干细胞具有特殊的分化潜能,因此在医用再生领域被广泛研究,并应用于不同的组织修复和再生中。而近期科学家们发现,干细胞在组织再生中,相较于其自身的分化潜能,可能更多是通过旁分泌作用调控了组织微环境以及其他细胞的行为。其分泌的外泌体,正是非常重要交流介质,起到干细胞与其他细胞之间的沟通交流。于是,科学家们在实验室培养大量的干细胞,进而提纯并收集外泌体,再研究其在组织修复以及疾病中的应用。
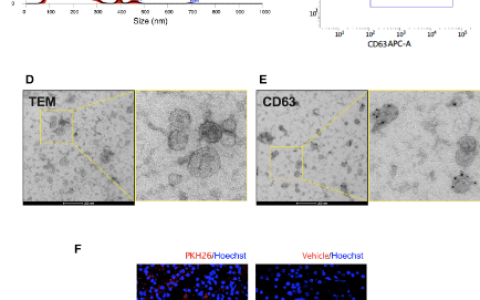
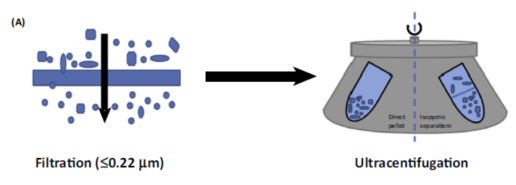
现如今有两类广泛使用的用于提纯外泌体的方法:超速离心法和Thermo Fisher等公司生产的提纯试剂盒。
超速离心法,主要是通过将实验室培养干细胞所得到的培养基通过滤膜滤掉尺寸较大的细胞碎片及细胞外囊泡后,通过超速离心机在100,000g的离心力的作用下富集得到外泌体。
提纯试剂盒,主要是通过试剂包被外泌体,使其尺寸和重量增大,从而在10,000g的离心力即可得到外泌体。试剂盒的使用有导致外泌体污染的风险,在科研领域超速离心法更为常见。
-03-
外泌体的生物学特性
由于外泌体在再生医美领域显示出极大前景,这也迎来产业化合作的新浪潮,眼下外泌体似乎已经成为下一个生物医药的黄金赛道。科学家们普遍认为,外泌体具有其独特的生物学特征,可以反映来源细胞的表型。
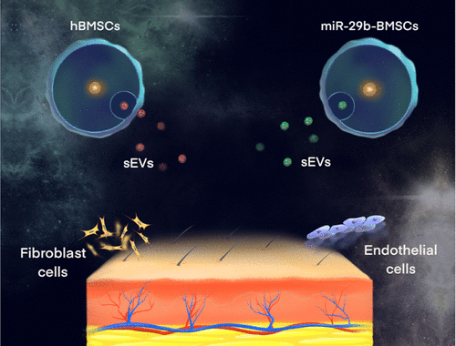
图 5 外泌体促进皮肤修复
不同细胞分泌不同的外泌体,因此外泌体的应用是多种多样的。一方面,外泌体被认为是多种癌症的疾病诊断生物标志物。外泌体独特的miRNA谱图和疾病载体作用,使得其频繁出现在卵巢癌、胶质母细胞瘤、黑色素瘤、前列腺癌和结肠癌。另一方面,外泌体也可以作为细胞信号传导的有效媒介而广泛用于医学再生领域。例如,它们能够将RNA和蛋白质的信息从来源细胞转移到周围环境中的其他细胞。实验证明,来自小鼠胚胎干细胞的外泌体在体外促进了小鼠造血干细胞的存活和扩展,同时也上调了受体细胞中与多能性相关的转录因子。干细胞来源的外泌体与生物材料相结合,促进骨组织以及关节软骨的修复和再生。
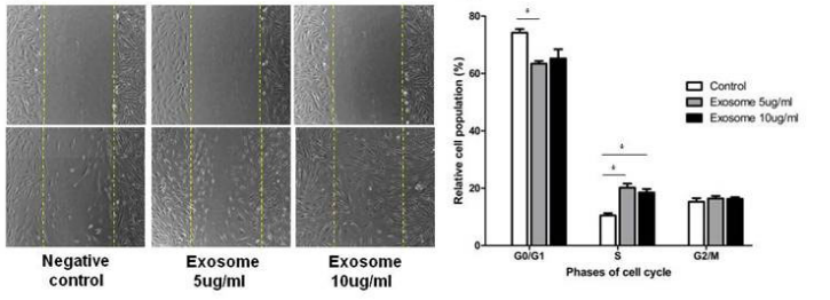
在皮肤组织再生中,外泌体的应用尤其广泛。如脂肪源外泌体能通过减少IFN-α的分泌而发挥免疫抑制作用,从而抑制T细胞的激活。此外,外泌体含有免疫调节蛋白如TNF-α、巨噬细胞集落刺激因子(M-CSF),从而通过良好的炎症调节保证了伤口愈合。而在皮肤愈合过程中,外泌体则能通过优化成纤维细胞特性加速皮肤伤口愈合。在一项研究中发现,外泌体上调199个miRNA,下调93个miRNA,促进真皮成纤维细胞增殖和分化,加速皮肤再生。
总而言之,干细胞来源的外泌体作用广泛。在皮肤再生中,外泌体可以通过调控炎症、促进皮肤修复等多方面提供作用;在疾病发展中,外泌体也参与多种病理通路。在未来,无论是组织再生、皮肤修复、还是疾病研究,外泌体都将在其中扮演重要角色。
-04-
外泌体的缺陷
外泌体具有诸多优点,在医用再生中具有难以忽视的价值。然而,外泌体的应用却还有所局限。
最适用于提纯外泌体的超速离心法,在提纯得到外泌体的过程中会导致大量的外泌体损失,至少80%的外泌体会因为收集的损失或者在超离过程中其独特的磷脂双分子层的膜破碎而无法维持其正常形态。
此外,外泌体在提纯后其保存比较困难,需要保存的试剂具有与体液类似的渗透压从而维持其磷脂双分子层的膜结构,否则其内含的具有生物功能的蛋白质和miRNAs也容易失去活性。另外,外泌体起到信号传导作用,但本身并不会提供结构支持。因此,在修复领域,外泌体难以单独使用。
-05-
细胞外基质:外泌体的最佳搭档
所有细胞均可分泌外泌体,外泌体充当着细胞之间信息交流的介质,因此外泌体生理功能的实现是通过一个细胞“出”而“进”入到另一个细胞内。在组织内部,必然要穿越细胞外基质。
因此,外泌体更适合作为细胞外基质的一部分来发挥价值,而细胞外基质的独特生理结构和生理稳态一来可以帮助维持外泌体的活性、二来也能与外泌体协同作用,实现更好的修复和再生效果。

在医用再生领域,科学家们研究各种各样的生物材料,并与外泌体进行复合促进组织的修复和新生。细胞外基质无疑是最安全的并且可以与外泌体协同发挥作用的生物材料。细胞外基质本身即源于人体,具有多元的组成(胶原蛋白、弹性蛋白、层黏连蛋白等等)。
一方面,细胞外基质能够起到结构支持作用,作为承载材料提供组织再生的根基;另一方面,细胞外基质中复杂的结构和靶点可以维持外泌体的活性,从而高效发挥外泌体的性能。外泌体可以通过进入细胞内发挥其优异的生物学功能, 而细胞外基质作为载体即可以为细胞的黏附和迁移提供平台。如果没有细胞外基质所提供的平台,那么外泌体会很快随着体内的生理循环和代谢而流失,从而失去了其作用效果。众所周知,外泌体价格昂贵。当外泌体由细胞外基质承载、由细胞外基质保护时,才会更好地提高其生物利用度,取得更好的修复效果。
图 7 细胞外基质提供结构支持和修复平台

组织修复和再生,与细胞微环境息息相关。简单来说,微环境由两个基本组成部分组成,一个是细胞外基质(ECM),而另一个是细胞分泌的外泌体、生长因子等功能性物质。二者缺一不可,彼此相辅相成、紧密结合。因此,光有外泌体,没有细胞外基质是远远不行的。
其实,除去细胞外基质对外泌体的负载和保护作用,其本身也具备出众的再生和修复能力。除了提供细胞存在的平台,细胞外基质的多元组成既可以为细胞的生理活动提供养分,并驻留在原位,成为机体自身的细胞外基质的一部分;又能够通过其本身的生物学特性来协同外泌体,实现更好的修复和再生效果。在经典的修复再生过程中,细胞外基质可以调节干细胞的表型和表达,而外泌体则含有控制干细胞分化的表型特异性指导因子(miRNA,RNA和蛋白质)。
图 8 皮肤修复与再生
简而言之,细胞外基质可以从拓扑结构、生物力学、功能靶点等多个维度与外泌体、生物因子共同作用,从而形成适于组织修复的胞外微环境。
首先,细胞外基质所含有的多种蛋白、多糖成分构建出其独特的三维结构和表面拓扑学特征。除支撑组织的生理形态外,还能够调控募集细胞的黏附、增殖和分化行为。近年来,人们更是发现细胞外基质构建的拓扑学结构与免疫细胞的免疫应答等行为息息相关,进而调控组织再生。
再者,细胞外基质本身具有其独特的生物力学性质。不同弹性模量、不同硬度的基质,能够引发细胞的不同表现行为和分化方向,也会引起细胞分泌和募集因子的不同。
细胞外基质极为多元的组成能提供不同的生物学效果,从而建立修复微环境。举例来说,细胞外基质中的纤连蛋白因可与细胞表面的整合素蛋白的α5β1结合,充当修复过程中细胞与细胞外基质交流沟通的重要参与者,并且调控细胞的黏附、增殖、形态和分化等行为;蛋白聚糖通过参与调节细胞外基质的组装和维持,并通过与生长因子的相互作用参与细胞增殖等细胞行为,在组织的生理和生物力学功能中发挥重要作用。正是由于细胞外基质打下的坚实基础,才能让外泌体、细胞因子等活性成分进一步“锦上添花”。
 图 9 细胞外基质多作用靶点
图 9 细胞外基质多作用靶点另外,近几年研究中还发现,细胞外基质的结构能结合和锚定多种生长因子(如VEGF,HGF等)、多肽短链。一方面,通过构型调整来更好地发挥其生物活性;另一方面,则能形成生长因子梯度,从而介导修复和再生过程的进行。可以想象,这是唯有细胞外基质才能实现的高度复杂而有序的生物过程。相比之下,仅仅使用外泌体完全无法实现上述空间上的介导过程。这也解释了为何直接使用外泌体或生长因子时,往往修复和再生效果并不如人所愿。
关于细胞外基质和外泌体之间的作用,目前依然还在不断研究中。然而,我们已经可以知道的是:细胞外基质是组织再生的舞台,而外泌体则是舞台上的演员。演员可以让舞台更加熠熠生辉,但舞台却是整个根基所在。二者有机结合,则能带来最好的演出效果。
-06-
细胞外基质/外泌体组合的应用
图 10 负载外泌体的ECM再生材料
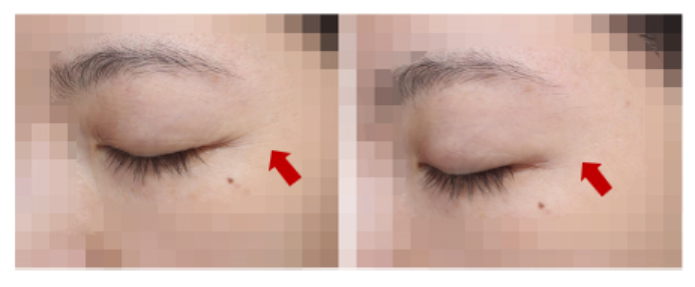
图 11 细胞外基质/外泌体组合在皮肤年轻化中的应用
-07-
文末小结
随着技术的进步,外泌体已经越来越被人们熟知,其应用也愈加广泛。外泌体是具有纳米尺寸的细胞囊泡,具有高生物活性,能参与细胞之间的交流,调控炎症水平、促进组织再生。然而,外泌体提取较为困难,本身也不具备结构性的功能,因此单独使用有所局限。
作为细胞外基质中的一部分,当外泌体回到细胞外基质中时,能够发挥出更为强大的作用,更起到“锦上添花”的效果。细胞外基质一方面是外泌体最理想的载体,帮助维持外泌体的活性;另一方面细胞外基质能够构建出最适宜再生的细胞外微环境,从而让外泌体能更加有的放矢。
目前,国内外相关的研究正如火如荼地进行中。相信,不久的将来,细胞外基质/外泌体这样的明星组合会越来越多地出现在我们面前。
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/wmt/21390.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫