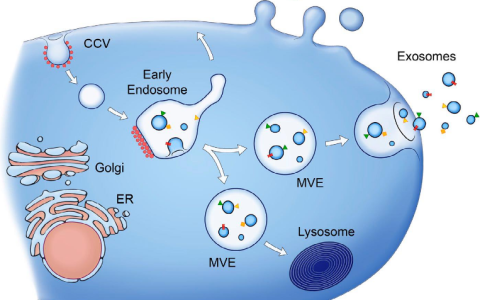
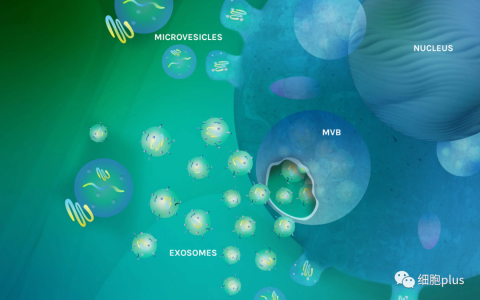
在细胞外囊泡存储方面,有许多变量需要考虑。在这里,我们分享了从收集时间到处理样品进行细胞外囊泡隔离之间要考虑的 7 个因素。
使用细胞外囊泡 (EV) 时,样品通常需要在两个主要阶段进行储存。首先,从采集到处理样品,将 EV 与样品中的其他成分分开。然后,一旦分离过程完成,样品中纯化的、含有 EV 的部分需要储存到分析和应用时间。
收集和存储技术的开发对于推进细胞外囊泡研究领域以及开发 EV 相关应用程序至关重要。以前,科学家们在 4 个原因中介绍了这一点的重要性,为什么储存条件对细胞外囊泡研究很重要。存储技术开发指南可在科学家们最近的应用说明中找到,标题为“如何存储细胞外囊泡:各种样品中 EV 存储的综合指南等”,以及大量已发布的最新资源与样品储存有关。
作为这个三部分系列的第二部分,我们重点介绍了在 EV 前隔离阶段存储样本时要考虑的七个因素:
1. 采血管的选择:对囊泡浓度的影响
最大限度地减少血小板的激活,以及随后体外释放血小板 EV,是处理血液样本时要考虑的最重要因素之一。采血管的选择是影响血小板活化的几个关键变量之一,因此是一个关键的考虑因素。离体释放的EV数量可能很大;例如,一项研究表明,与采集时相比,采集三小时后全血中基于数量的微泡浓度大约高出七倍;这在收集在肝素管中的样本中得到了体现,样本在 37°C 下轻轻滚动储存。这种趋势也在储存在含有柠檬酸钠或 EDTA 的管中的全血中观察到,但程度较小。对于在相同条件下储存的血浆样品,当使用肝素或柠檬酸盐试管三小时后,微泡浓度也增加,而在 EDTA 血浆中采集样品后计数没有增加。
2. 蛋白酶抑制剂在尿样中的应用
蛋白酶抑制剂可防止蛋白质降解,包括与 EV 相关的蛋白质。已通过蛋白质印迹法证明了添加到尿液中的蛋白酶抑制剂对典型尿液 EV 膜相关蛋白的影响,这表明当使用蛋白酶抑制剂时,尿液 EV 制剂中存在更大的信号。应立即添加蛋白酶抑制剂鉴于有证据表明 EV 在尿液收集后数小时内迅速降解。
3. 去除牛奶中丰富的混杂结构
牛奶样品因其高脂肪和酪蛋白含量而需要特殊处理。例如,在通过离心去除细胞后,在储存或处理上清液之前,需要小心去除上层脂肪(含有乳脂肪球)。牛奶和山羊奶需要特别注意,因为它们含有特别高水平的酪蛋白,而由此产生的酪蛋白胶束可能会给EV的分离带来挑战。已经提出了几种方法来帮助酪蛋白聚集和随后的去除,例如添加乙酸或盐酸。但是,在使用这些酸性处理时必须小心,因为它们会影响 EV 表面标记。
4. 如果可能,立即纯化 BALF 样品
理想情况下,EV 应该从新鲜的支气管肺泡灌洗液 (BALF) 样本中分离出来,因为冷冻会导致聚集体的存在。
5. 唾液的特殊考虑
与大多数其他样品相比,唾液具有很高的粘性。因此,建议在继续处理之前用 PBS 或 Tris 缓冲盐水稀释。在 EV 分离或储存之前,应使用适当的速度离心,不仅可以去除受试者的细胞,还可以去除微生物细胞(需要不同的离心设置)。
6. 评估细胞培养中的细胞死亡
应尽量减少体外细胞死亡,以避免样品被来自压力和/或死细胞的 EV 污染。这可以通过在 EV 分离前确定可接受的限度并分析细胞死亡程度来有所缓解。
7. 最后一个重要的问题:你记录了一切吗?
研究人员已经发现了许多可能影响EV数量和组成的变量,但仍然存在未知数。养成细致记录的习惯当然是进行实验的好习惯——随着进一步传播影响EV的参数,这可能会有所帮助。
References
- Fendl B, Weiss R, Fischer M, Spittler A, Weber V. Characterization of extracellular vesicles in whole blood: Influence of pre-analytical parameters and visualization of vesicle-cell interactions using imaging flow cytometry. Biochemical and Biophysical Research Communications. 2016;478(1):168-173. doi:10.1016/j.bbrc.2016.07.073
- Zhou H, Yuen PST, Pisitkun T, et al. Collection, storage, preservation, and normalization of human urinary exosomes for biomarker discovery. Kidney International. 2006;69(8):1471-1476. doi:10.1038/sj.ki.5000273
- Oosthuyzen W, Sime NEL, Ivy JR, et al. Quantification of human urinary exosomes by nanoparticle tracking analysis. The Journal of Physiology. 2013;591(23):5833-5842. doi:10.1113/jphysiol.2013.264069
- Rahman MdM, Shimizu K, Yamauchi M, et al. Acidification effects on isolation of extracellular vesicles from bovine milk. Fan G-C, ed. PLOS ONE. 2019;14(9):e0222613. doi:10.1371/journal.pone.0222613
- Carnino JM, Lee H, Jin Y. Isolation and characterization of extracellular vesicles from Broncho-alveolar lavage fluid: a review and comparison of different methods. Respiratory Research. 2019;20(1). doi:10.1186/s12931-019-1210-z
- Ogawa Y, Taketomi Y, Murakami M, Tsujimoto M, Yanoshita R. Small RNA transcriptomes of two types of exosomes in human whole saliva determined by next generation sequencing. Biological & Pharmaceutical Bulletin. 2013;36(1):66-75. doi:10.1248/bpb.b12-00607
- Witwer KW, Buzás EI, Bemis LT, et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2013;2(1):20360. doi:10.3402/jev.v2i0.20360
- Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 2018;7(1):1535750. doi:10.1080/20013078.2018.1535750
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/wmt/10964.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫