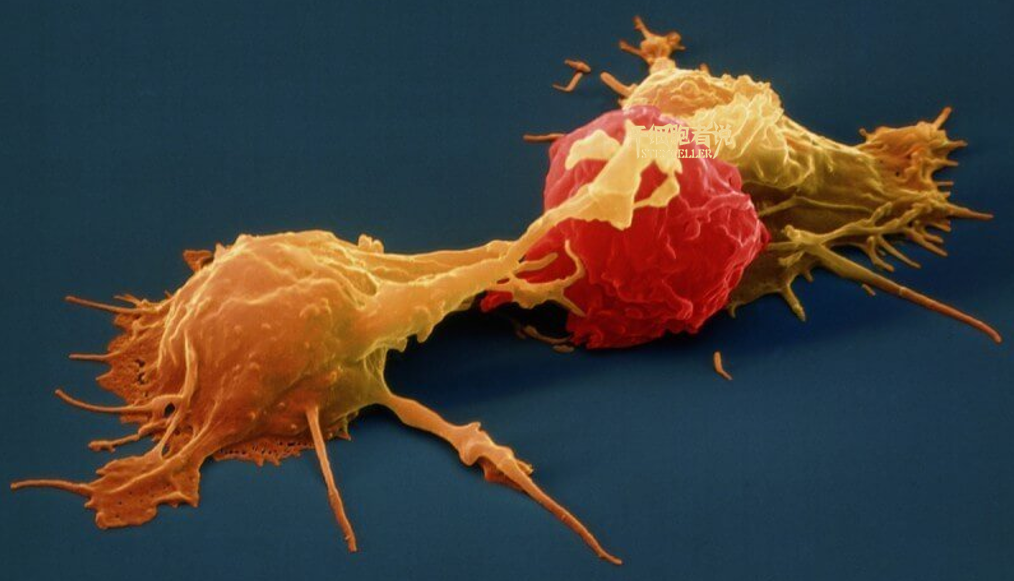
图 | NK 细胞(黄色部分)攻击肿瘤细胞(红色部分)图示(来源:Science)
● ● ●

NK细胞已经成为抗肿瘤免疫治疗的重要靶点。今天,我们来了解一下如何激活人体免疫“第一反应者”——NK细胞。
NK细胞激活机制
NK细胞是由一系列激活和抑制受体转导的信号之间的动态平衡调节的。正常细胞表面通过表达MHC-I分子,引发NK细胞的抑制性信号传导,避免NK细胞的攻击。
然而,病毒感染的细胞或肿瘤细胞通常下调MHC-I的表达,逃避依赖于检测MHC-I呈递的抗原肽的CD8+T细胞的识别。相反,这种MHC-I抑制性受体配体的缺失和/或活化受体配体的上调,可使NK细胞激活,从而引发NK细胞的自发攻击。NK细胞激活后,通过释放大量的穿孔素和颗粒酶来诱导靶细胞凋亡。
NK细胞杀伤肿瘤细胞主要通过以下四种方式完成,分别是:
NK细胞低亲和力的CD16分子与靶细胞IgG抗体复合物结合后,活化蛋白酪氨酸激酶(PTK),使PLC γ的酪氨酸磷酸化,裂解膜磷酯酰肌醇为三磷酸肌醇(IP3)和二酰甘油,IP3增加细胞内游离钙浓度,进而释放细胞毒性物质(如穿孔素和颗粒酶)。
–02–
细胞因子激活NK细胞
细胞因子是维持多种免疫细胞激活和功能性的关键成分,通过多种激活性细胞因子或抑制性细胞因子的拮抗剂,能够刺激并增强患者NK细胞的抗肿瘤作用。
IL-2可直接刺激T细胞和NK细胞的增殖和活化。最初发现用IL-2刺激人外周血单核细胞会扩增细胞毒性细胞,命名为淋巴细胞活化杀伤细胞(LAK)。随后的研究发现,LAK细胞对肿瘤的破坏主要由NK细胞介导。后续研究发现,IL-2可诱导抑制性调节性T细胞(Treg)的产生,其限制了IL-2激活NK细胞的应用。
▉ IL-15
IL-15是IL-2最有前途的替代品。重要的是,IL-15刺激NK和CD8+T细胞,但不刺激Treg细胞。体外研究表明,IL-15可以增强被TME(肿瘤微环境)耗尽的NK细胞的功能。在缺氧条件下,用IL-15治疗功能失调的肿瘤来源的NK细胞,可以恢复线粒体的完整性,增加颗粒酶B的表达,减少细胞凋亡,增强NK细胞毒性和IFNγ的产生[1]。
▉ IL-12
IL-12主要由抗原呈递细胞,特别是DC和巨噬细胞产生,刺激CD8+T细胞和NK细胞的募集、效应功能和IFNγ的产生。除了直接激活NK细胞外,IL-12还刺激Th1产生IFNγ和IL-2,从而刺激NK细胞产生更多的IFNγ、穿孔素和颗粒酶B[3]。
IL-12全身给药会引起多种不良副作用,在最大耐受剂量下也只能发挥有限的抗癌功效,目前正在开发替代的IL-12递送方法(如抗体融合的IL-12、IL-12的DNA/RNA的直接递送、瘤内注射外泌体表达的的IL-12)以期改善IL-12疗效。
▉ IL-18
IL-18是一种促炎细胞因子,由多种细胞产生,包括髓细胞、肠上皮细胞、角质形成细胞和内皮细胞。IL-18(与IL-12联合)能够诱导NK细胞表达FASL、增强NK细胞产生IFNγ和TNF的能力、促进NK细胞增殖,并通过诱导CCL21、CCR7的表达促进NK向次级淋巴器官迁移。
▉ IL-21
IL-21由Th17细胞和DC细胞产生。IL-21通过刺激NK细胞增加穿孔素和颗粒酶B的表达,并上调NKp30和NK细胞受体2B4来增强NK细胞的成熟和增殖,并增强其细胞毒性活性[5]。常IL-2、IL-15、IL-18等细胞因子联合使用。
▉ TGF-β抑制剂
TGFβ能够抑制NK细胞功能,并促进其分化为ILC1,成为毒性大大降低的组织驻型细胞,对肿瘤的杀伤作用大幅度减弱,抑制肿瘤微环境中的TGFβ是恢复NK细胞功能的重要策略。针对TGFβ的药物大致有三类:中和抗体、配体陷阱、受体激酶抑制剂。
–03–
多少肿瘤的发展与NK细胞功能异常有关。因此,NK细胞功能的恢复可能是抗肿瘤免疫治疗的潜在选择。在T细胞参与的抗肿瘤过程中,免疫检查点抑制已研究成功。NK细胞同样也有相同的抗肿瘤机制。
在NK细胞背景下,尝试基于T细胞的免疫检查点抑制剂(例如CTLA-4和PD-1抑制剂)的组合,如抗PD-1和抗PD-L1抑制剂也已显示增强NK细胞介导的细胞毒性。通过研发更新的免疫检查点(例如B7-H3,CD200R,CD47和Siglecs7/9),将这些检查点组合以产生协同的抗肿瘤反应似乎更加合乎逻辑。
除此之外,还有一些NK特有免疫检查点:
▉ NKp44
NKp44,其胞质结构域包含一个免疫受体酪氨酸抑制(ITIM)基序,表达PCNA的肿瘤细胞与NK细胞接触结合时,通过NKp44-PCNA轴传导抑制信号。
▉ KIR3DL3
KIR3DL3,可能受免疫抑制性TME诱导而表达上调,通过与配体HHLA2结合传导抑制信号。KIR,第一个开发用于刺激NK细胞反应的ICI抗体。
▉ NKG2A
NKG2A,主要存在于实体瘤浸润性NK细胞中,其配体HLA-E在多种肿瘤中表达被上调。
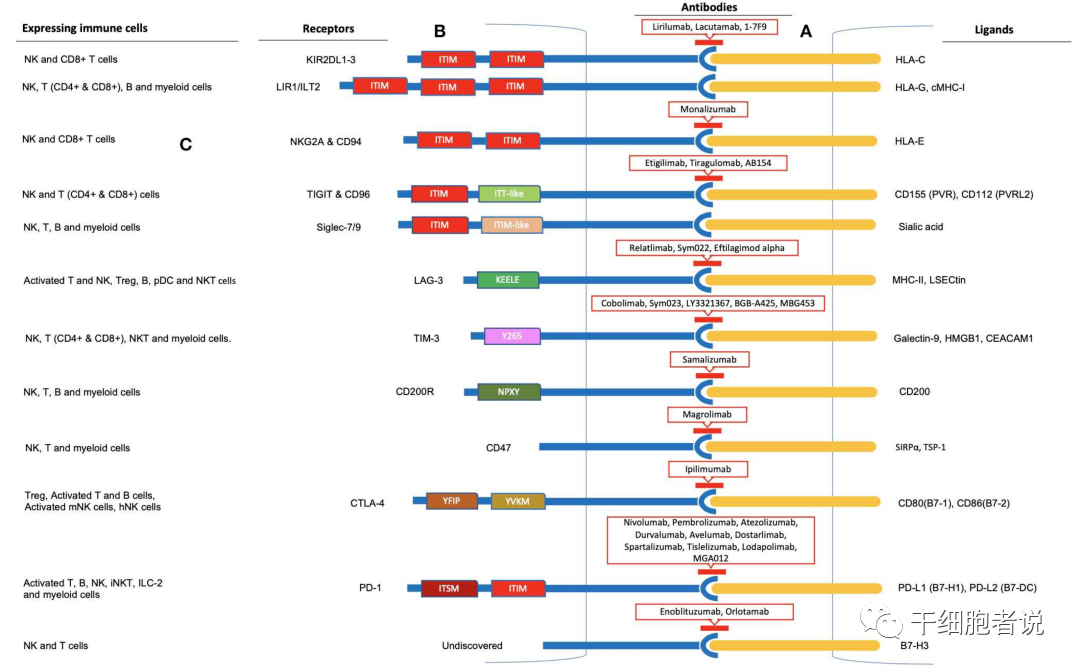
如图,NK细胞中的免疫检查点抑制作用:
–04–
NK细胞可通过CD16受体介导的ADCC,杀死IgG1或IgG3抗体靶向的细胞。NK细胞表面CD16的不同形态,会影响CD16与抗体Fc端的亲和力。
具体来说,CD16蛋白第158位的氨基酸为苯丙氨酸(158F)时,与Fc的亲和力低,而这一位置上的氨基酸为缬氨酸(158V)时,与Fc的亲和力高。新一代单克隆抗体疗法很多对Fc端进行了修饰,改善了它们与CD16的结合,促进了ADCC的产生。同时,很多抗体在合成时使用了预防抗体Fc端岩藻糖基化的哺乳动物培养系统,增强了它们与CD16的结合。
▉ 双特异性抗体
▉ 三特异性抗体
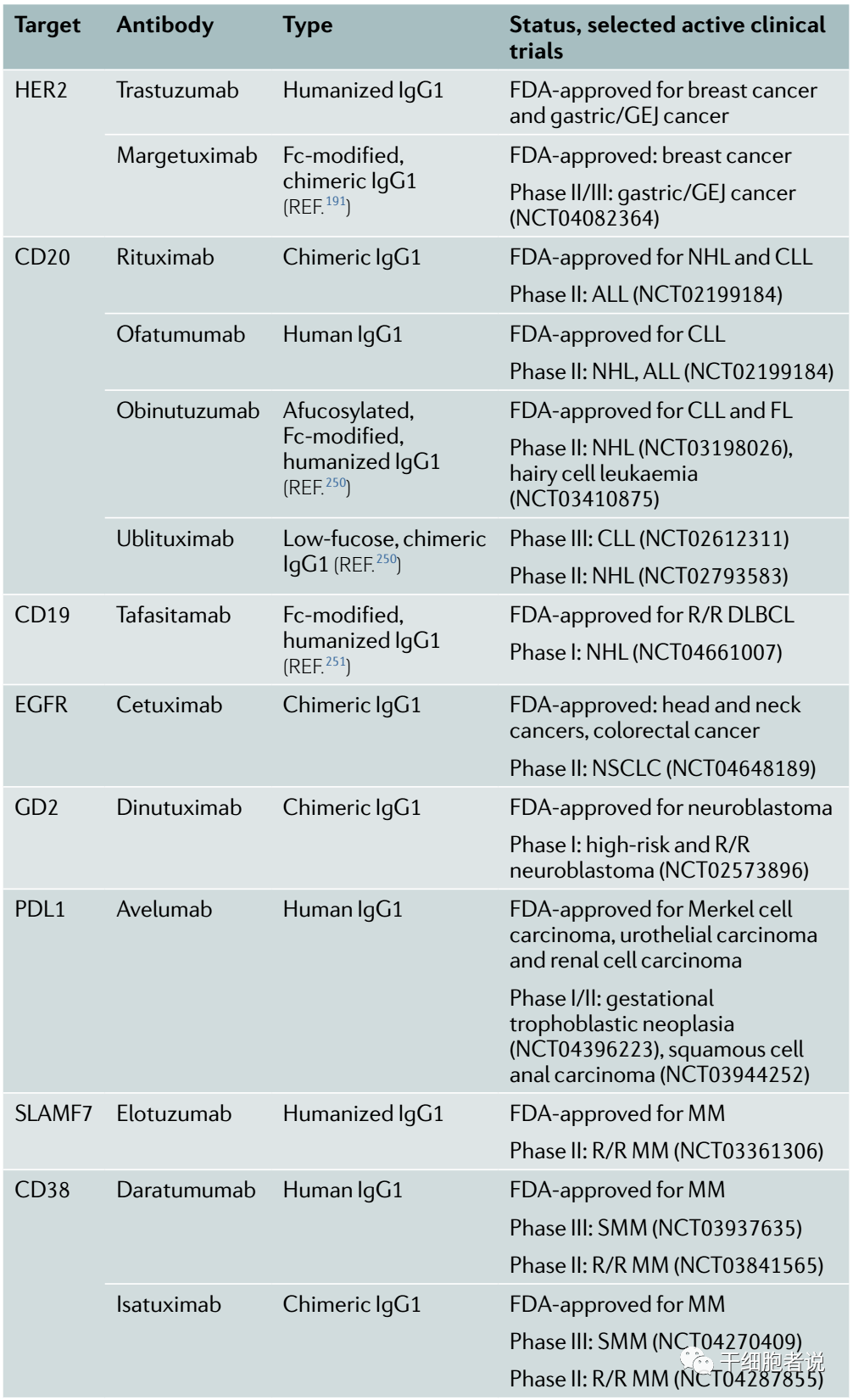
Nat Rev Drug Discov. 2022 Aug;21(8):559-577.
–06–
自然杀伤细胞(NK细胞)具有独特的抗肿瘤效应,不受MHC限制的细胞毒性、产生细胞因子和免疫记忆等功能,使其成为先天性和适应性免疫反应系统中的关键角色。早期临床数据表明:NK细胞非常适合用于异体治疗环境。
临床研究表明,NK细胞在治疗血液系统恶性肿瘤方面具有安全性和有效性。重要的是,无论采用哪种方法,NK细胞疗法都一直显示出良好的安全性。迄今为止,没有观察到CRS或GVHD。然而,大多数报道的成功仅限于血液系统恶性肿瘤,并非所有患者都对NK细胞治疗有反应,有些患者最终会复发。
CAR-NK细胞疗法是一个很有前途的临床研究领域,对某些癌症患者具有良好的安全性和初步疗效。相信,基于NK细胞的新型细胞疗法可能会引发肿瘤免疫治疗的革命性进展。
参考资料:
[1] Laskowski, T.J., Biederstädt, A. & Rezvani, K. Natural killer cells in antitumour adoptive cell immunotherapy.Nat Rev Cancer (2022).
[2] Maskalenko et al., Harnessing natural killer cells for cancer immunotherapy: dispatching the first responders. Nature Reviews Drug Discovery, (2022).
[3] Le Saux and Schvartzman Advanced Materials and Devices for the Regulation and Study of NK Cells. Int. J. Mol. Sci., (2019).
[4] Zhang et al.,. CAR-NK cells for cancer immunotherapy: from bench to bedside. Biomarker Research,(2022)
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/myxb/32544.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫