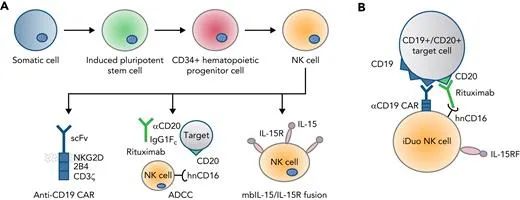
病毒载体与转导选择
与逆转录病毒载体相比,基于慢病毒的转导更安全,因为具有较低的遗传毒性和插入诱变。通常,原代NK细胞中慢病毒转导的效率较低,通常需要多轮转导。
同时,CAR-NK细胞疗法的GVHD风险很小。但是,其低密度脂蛋白受体的表达水平也很低,而这是VSV-G的主要转导受体。因此,需要选择NK细胞转导特异性的载体。
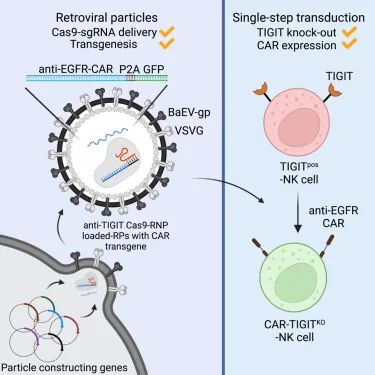
目前认为,狒狒包膜伪型慢病毒载体(BaEV-LV)可显著提高NK细胞的转导效率。此外,通过类病毒颗粒运送CRISPR基因组编辑成分,也逐渐成为热门的方法。转导CAR和基因敲除可以共同进行。
电穿孔和脂质转染等转染方法,也被用于将外源基因递送到NK细胞中。目前,著名的转座子系统包括PiggyBac和睡美人等。与病毒转导相比,NK细胞的转染与转基因的表达更快,细胞凋亡水平更低,个体间变异性更小,基因转移效率更高有关。
不过,转座子系统在转导原代NK细胞中的适用性,仍需要进一步修改,以克服转导效率低和质粒DNA电穿孔对NK细胞的细胞病变效应等问题。
–02–
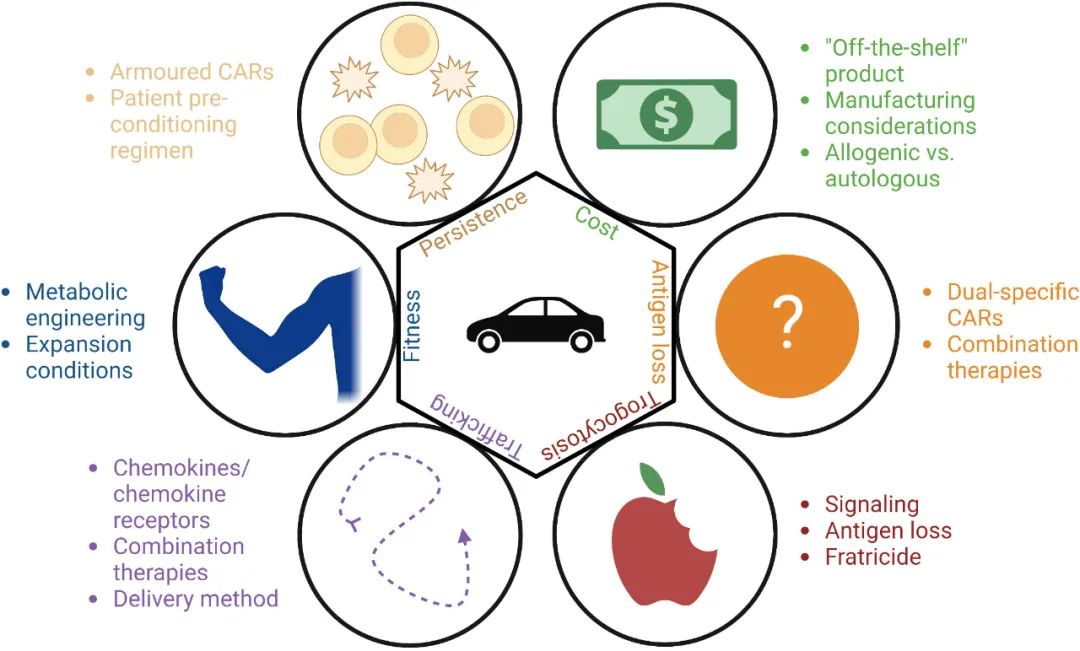
CAR-NK细胞的持久性
CAR-NK细胞持久性不如CAR-T细胞,这是NK细胞疗法临床疗效有限的原因之一。目前认为,短期接触IL-12、IL-15和IL-18可产生持续时间更长的记忆样NK细胞。
临床前预处理,也是CAR-NK细胞临床应用持久性的影响因素之一。通常,在接受CAR-NK细胞治疗之前使用氟达拉滨/环磷酰胺的组合,以减少宿主对NK细胞的排斥反应,重新编程免疫抑制的肿瘤微环境,并降低肿瘤负担。
细胞剂量上,在过继转移未经修饰的NK细胞疗法之前,高剂量方案能够更好地使体内NK细胞的扩张和持久性满足需求,而低剂量方案不能。
不过,持久性要到什么程度才合适?
是越长越好吗?
也不尽然。
目前认为,仅需要在特定的肿瘤中强调增强NK细胞的持久性。CAR-T细胞疗法的经验表明,在比如淋巴瘤等类型中,患者可以在不延长CAR-T持续时间的情况下产生持久的反应。这或许是CAR-NK细胞可以借鉴的。
到目前为止,优化NK细胞CAR结构的目标大多集中在提高细胞毒性上,而非持久性。CAR-NK的低免疫原性,还使其能够通过多次给药来弥补持久性问题。
–03–
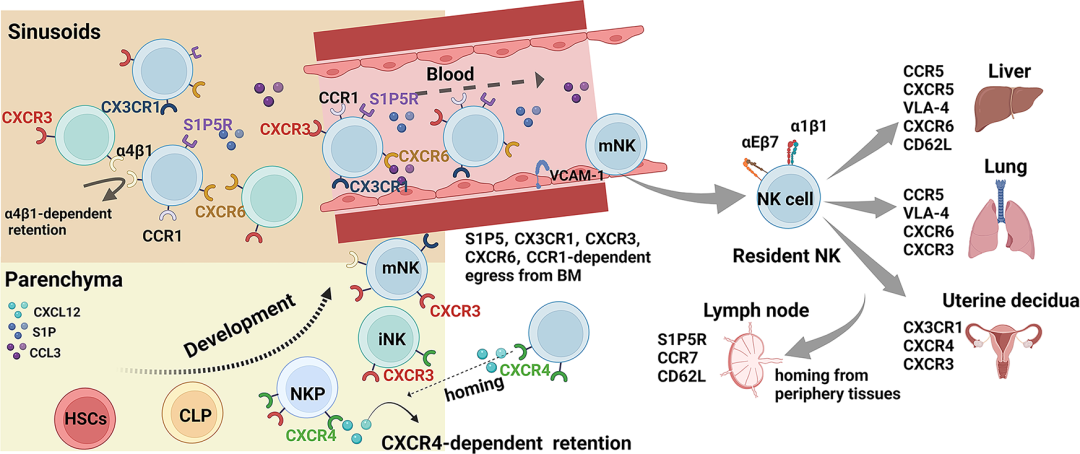
–04–
营养代谢主要是针对实体瘤的适应症。在肿瘤微环境中,相当多的营养代谢屏障阻碍了免疫细胞发挥功能,包括:缺氧、缺乏营养、低pH值和各种代谢产物水平升高。
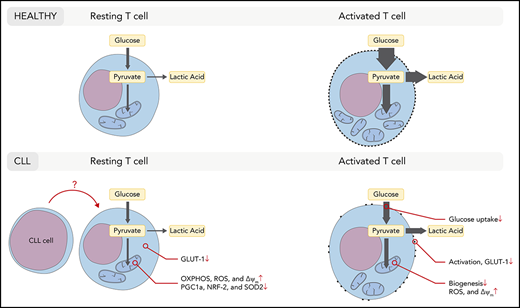
Blood
改善代谢的策略包括:
-
通过在体外扩增过程中直接操纵细胞代谢; -
基因工程改造T细胞。NK细胞也适用。
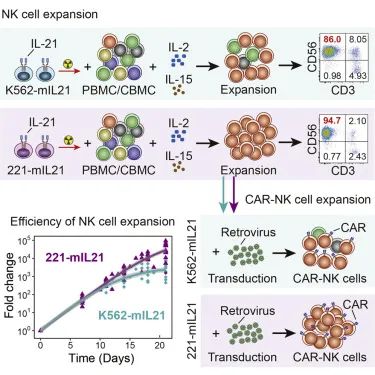
例如,采用mIL-21在体外扩增NK细胞和CAR-NK细胞的研究显示:扩增所得的与富集代谢途径相关的NK细胞分化程度较低,未耗尽表型、记忆样表型的比例提高,并能抑制CAR-NK细胞的“自相残杀”。
NK细胞比T/B细胞更容易受到肿瘤微环境中过氧化氢的影响。有研究通过基因改造NK细胞使其过表达过氧化物还原蛋白-1(PRDX1),该细胞在氧化应激下对乳腺癌细胞显示出有效的抗肿瘤活性。
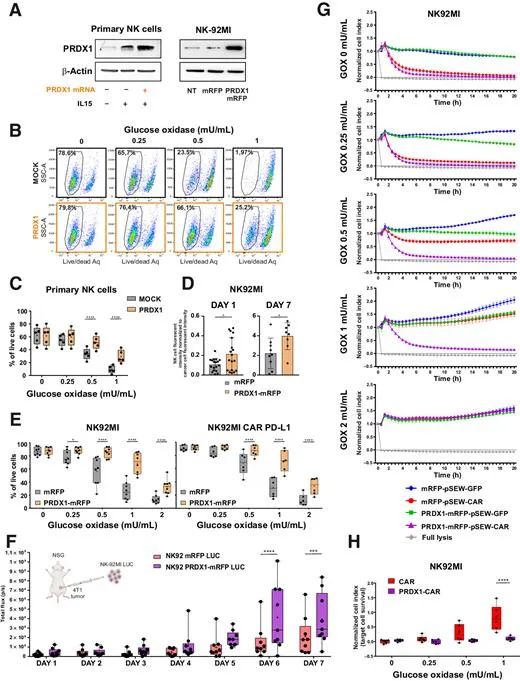
Cancer Immunol Res.
-
设计双靶点CAR-T细胞; -
不同CAR的CAR-T细胞顺序给药; -
联合溶瘤病毒给药。
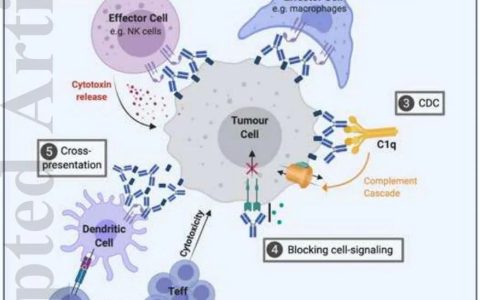
不同于CAR-T细胞,NK细胞能够通过先天受体(NCR、CD16、DNAM-1或NKG2D/DAP10等),在CAR抗原丢失或者下调的肿瘤逃逸环境中保留非CAR依赖性杀伤能力。
此外,双靶点CAR-NK细胞目前也有临床前开发,例如包含具有NKG19D跨膜和2B2/CD4ζ信号结构域的CD3靶向CAR表达。
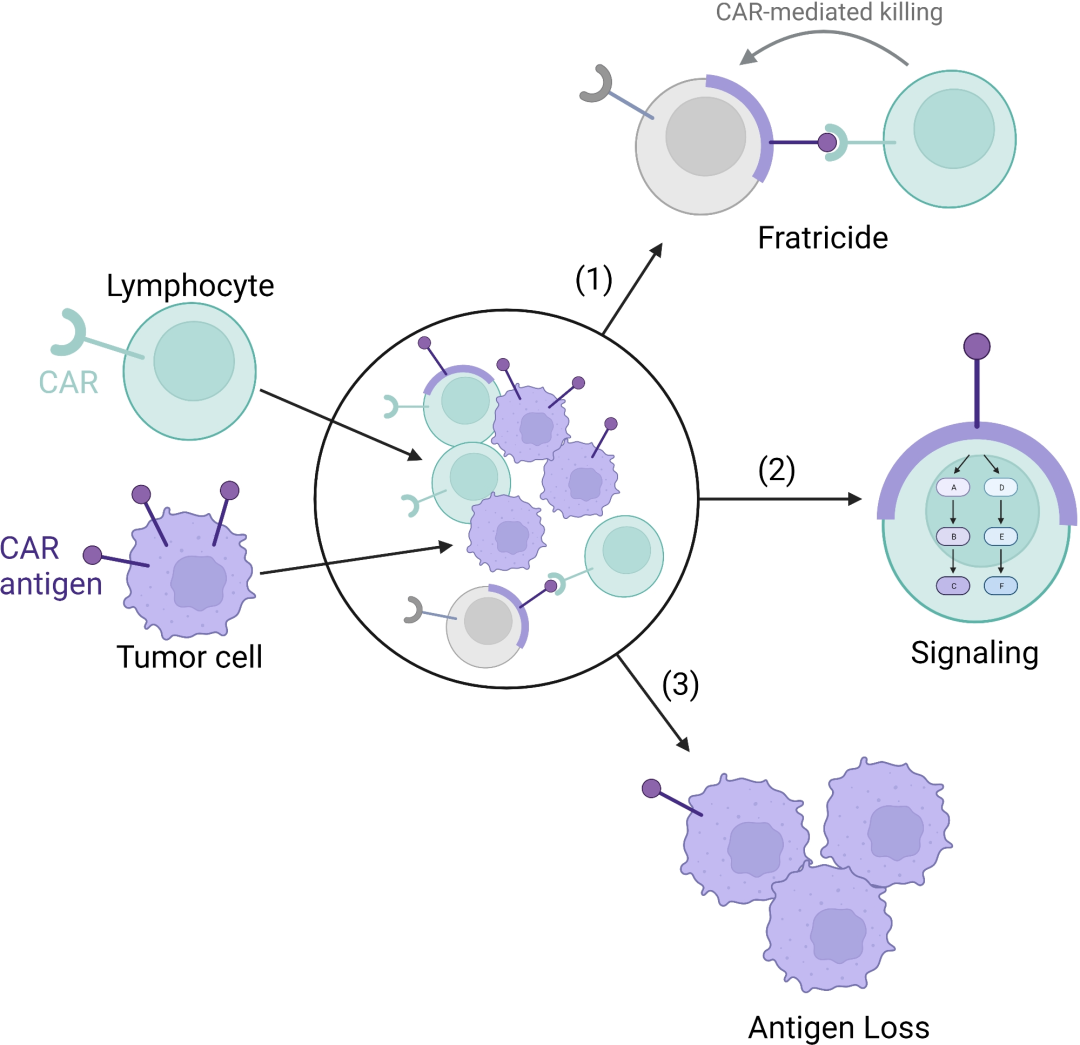
Blood
胞啃作用(Trogocytosis):信号传导影响、抗原丢失、自相残杀。
▉ 胞啃作用的积极影响:
通过胞啃作用,NK细胞可以获得趋化因子受体(如CCR5、CXCR4、CCR7或TYRO3等)。CCR7的获得,增强了NK细胞归巢到淋巴结的能力,而TYRO3则提高了效应器的功能和增殖水平。
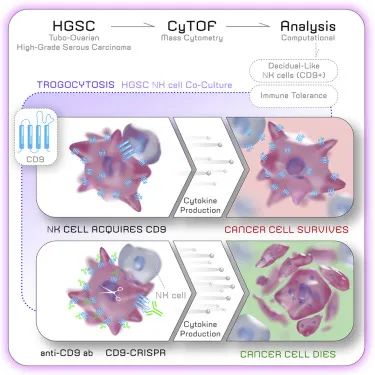
▉ 胞啃作用的抑制影响:
通过胞啃作用,CAR-NK细胞可获得免疫抑制蛋白来抑制其细胞毒作用。例如:在白血病环境中,NK细胞能从白血病细胞上获得PD-1;在卵巢癌中,NK细胞从卵巢癌细胞上获得CD9,抑制细胞毒作用。克服胞啃作用介导的信号传递是使用针对目标抗原的封闭抗体。例如在卵巢癌中,有研究通过在CD9的情况下,使用CD9阻断抗体在体外恢复NK细胞的细胞毒性。
▉ 胞啃作用与靶细胞抗原丢失
胞啃作用的另一个后果是靶细胞抗原丢失。虽然这已经在CAR-NK细胞中显示出来,但它在CAR-T细胞中得到了更多的研究。由于抗原密度影响CAR的功能,靶抗原的下调或内化可导致肿瘤逃逸。因此,克服胞啃引起的抗原丢失可以提高肿瘤的清除率。
第一种方法是通过调整CAR与靶抗原的亲和力。低亲和力结构被认为能在保持疗效的同时减少了胞啃作用。在CAR-T细胞疗法中已有临床前研究证明,低亲和力的CD19 CAR-T细胞能够显着限制胞啃作用,同时保持抗肿瘤活性和临床疗效。
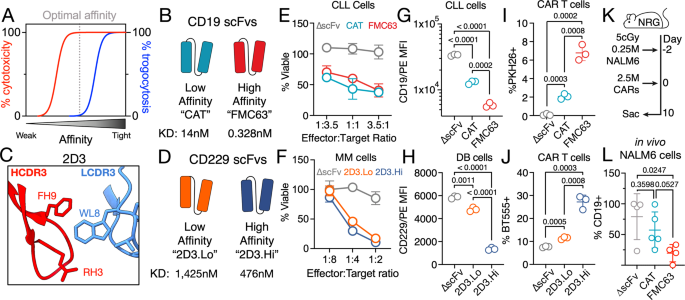
另一种方法是调整CAR的信号域。因为胞啃作用已被证明在不同程度上影响具有CD28或4-1BB信号域的CARs。不过这种机制的影响效果差异很大,主要取决于抗原密度。
胞啃作用使抗原转移到NK细胞的最终结果是,介导了NK细胞对其他NK细胞的杀伤。在内源性T细胞或NK细胞的抗原(如CD7或CD38)的背景下,敲除效应细胞中的靶抗原可以克服同胞杀伤,但这种方法不适用于通过胞啃转移到效应细胞的抗原。
说不热门吧,CAR-NK在血液瘤和实体瘤中均有不少企业布局。2023年5月6日,国家药品审评中心(CDE)受理了启函生物的同种异体CD19 CAR-NK的IND申请;
说热门吧,不少备受关注的CAR-NK细胞产品则临床迟迟没能推进。行业先锋的Fate还在2023年1月5日宣布与强生的合作终止,同时选择聚焦开发第二代CD19 CAR-NK疗法,终止开发FT596项目。
这正是表明,CAR-NK细胞结构和设计上的迭代需求和技术,都已经赶上了实际临床试验的推进进度。这也给后来的企业更多的机会,通过技术弯道超车,未尝不可实现。
参考资料:
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/myxb/31268.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫