大家都知道在欧盟,细胞治疗产品归属高级治疗药物(ATMPs)进行管理,不过ATMPs有着不同于传统药物的上市许可(MA)的管理方式。
最独特的一点就是,ATMPs允许在特殊条件下使用医院豁免(HE)。该豁免权来自开发ATMP的学术中心(通常是医院)认可,并可由各个国家主管当局(NCA)授予。
譬如在西班牙,是由西班牙药品和医疗器械机构(AEMPS)授权。
2021年2月,一种新的靶向CD19的CAR-T在西班牙就作为享受医院豁免HE的ATMPs产品率先上市(由西班牙药品和医疗器械管理局(AEMPS)批准),该批准允许医疗机构使用ARI-0001并由西班牙国家医疗保健系统报销。
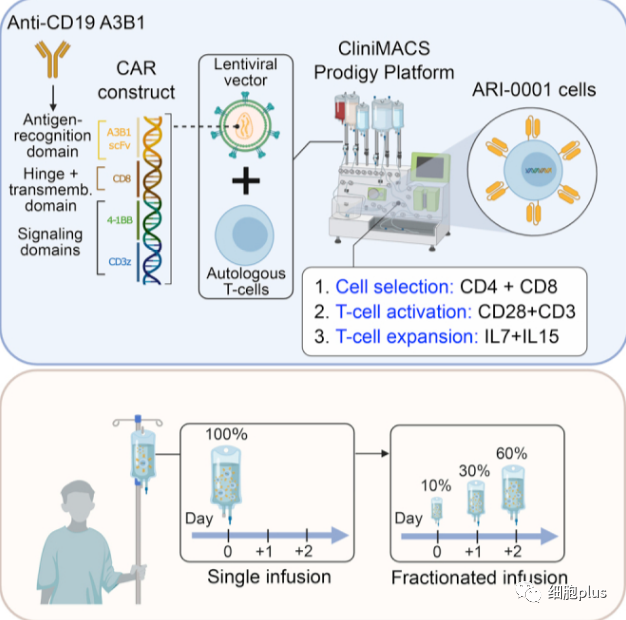
图一 ARI-001产品的制造和回输
与传统药物上市许可(MAs)不同,HE是由国家主管当局(NCA)授予的,允许在特殊条件下提供ATMP:
(1)它限于特定法规下的欧盟(EU)每个成员国;
(2)仅限于授权医院,主要发展ATMP;
(3)它是由该医院的工作人员负责使用的。
该批准途径由欧洲法规[EC]1394/2007、修正指令2001/83/EC和EC No . 726/2004建立,并由西班牙关于ATMPs的立法(RD 477/2014)补充,明确要求在任何HE授权前提供关于疗效和安全性的临床数据。
到目前为止,除西班牙之外,欧盟共有九个国家制定了HE规则。
遵循这一途径,ARI-0001成为欧盟开发的第一个基于遗传修饰细胞的治疗方法,也是第一个由NCA批准的CAR-T细胞治疗方法,不在MA途径之内,这一事实可被视为欧盟人类细胞和基因治疗的里程碑。
ARI-0001是作为一种非传统医药工业方法开发的,具有与欧洲ATMP法规相同的质量和安全标准,它获得了有条件的授权,因为它解决了一个未满足的医疗需求:患有R/R ALL的“成人”(> 25岁)的治疗。
HE授权意味着ATMP的批准向前迈进了一步,ATMP用于等待EMA授权的药物未涵盖的特定医疗需求,或用于孤儿适应症。
因此,ARI-0001不仅能够比传统药品上市方案更接近真实临床实践的途径,还可以成为欧盟国家卫生系统增加患者获得最先进细胞治疗的机会。
急性淋巴细胞白血病是一种罕见的疾病(据估计,欧洲的总体年发病率仅为每100000名居民1.28例),尤其是在成年人群中。成人的所有预后都很差,治愈率只有40%,R/R患者的预后更差。在FDA和/或EMA授权的当前CART19产品中,只有Kymriah被批准用于所有目前,ARI-0001是唯一被授权用于25岁以上R/R ALL患者的CART19产品。
纵观全球ATMP在西班牙的发展,ARI-0001是第二个被AEMPS批准为医院豁免的ATMP,第一个获得医院豁免的产品是2年前的NC1(一种由马德里Puerta de Hierro医院为脊髓损伤后遗症患者开发的自体间充质基质细胞产品)。
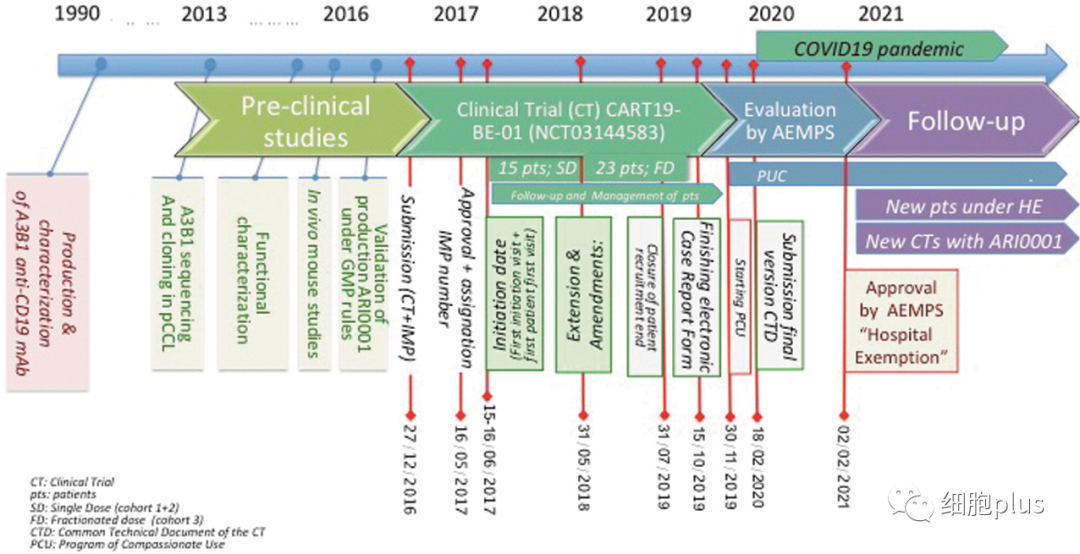
图二 在AEMPS最终批准HE下的ARI-001的事件年表。
在这项研究中,我们想强调的是,ATMP对于细胞产品在欧洲发展的是一个巨大机遇(对于那些认可和接受这种选择的国家而言),因为它接近真正的临床实践,并提供快速的治疗途径。
主要一个原因是一些疗法(主要是那些发病率低的疾病,如大多数儿科癌症)只能以医疗技术的形式提供给患者。
医疗的科研中心可以为孤儿疾病开发ATMPs,并申请HE授权。
事实上,针对ATMPs,如果只有医药公司开发的商业产品,ATMPs的高价格对国家卫生系统来说可能是难以承受的。(这个问题在全球,包括美国、中国都存在,至少医保是不可承受的)。
从这个意义上说,HE可以提供一个互补的机会,平衡这些成本。例如ARI-0001在西班牙的成本不到市售CAR-T19产品价格的1/3。这种差异是有利于欧盟卫生保健系统发展的可持续性。
ARI-0001被开发出来,并按照HE路线送到患者床边。接下来需要执行为期3年的“有条件许可”,接受每年的跟踪报告和对数据的重新评估,以获得另一个5年的续期。
特别值得强调的是,HE批准ARI-0001可作为欧盟ATMPs未来发展的模型。
ARI-0001之所以成为可能,要归功于由近200名专业人员组成的多学科团队的工作和专业知识,他们参与了这一过程的各个步骤。物流资源的可用性(带有CAR-T制造设施的洁净室)也是这一发展的关键支柱,这也反映了西班牙对R&D&I的承诺。ARI-0001之所以在财政上成为可能,还得益于包括“ARI项目”在内的公共-民间合作,以及卡洛斯三世卫生研究所的几笔公共赠款(根据该项目,近1500名个人、23个协会和基金会以及56家公司进行了捐赠)。
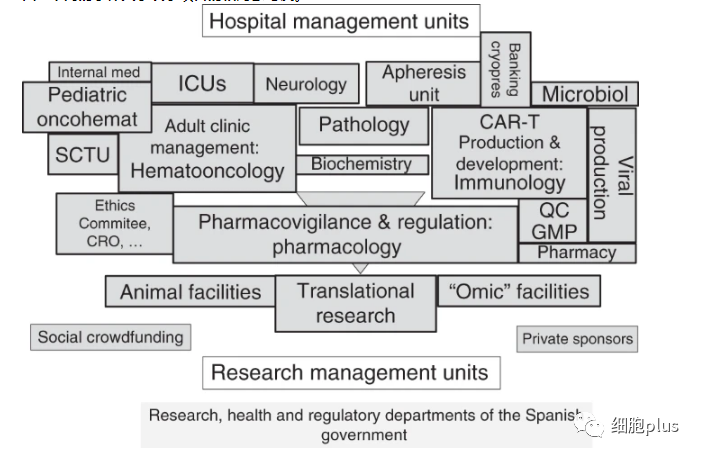
图三 整个ARI-0001医院管理体系
结论
目前已有多个欧盟成员国都明确规定了CAR-T ATMP的审批途径,这同时可以成为EMA请求药品上市之前的一个中间步骤。如果获得EMA的批准,最终将允许来自学术界的ATMPs广泛使用,从而获得“真实世界”的经验。
HE医院豁免还可以帮助实现ATMPs的更快和更个性化的使用,以更综合的方式改善欧盟其他许多有前途的疗法的发展。
是时候让全球每个国家的“立法权力”来决定他们是希望赌上这一替代选择,还是仅仅希望继续在传统的以制药为基础的规则下运作。
为了拥有未来,新的挑战需要新的工具和新的标准,以在我们的世界中实现更新、更个性化、更可持续的发展……至少在健康层面更应该如此。
参考文献:Trias, E., Juan, M., Urbano-Ispizua, A. et al. The hospital exemption pathway for the approval of advanced therapy medicinal products: an underused opportunity? The case of the CAR-T ARI-0001. Bone Marrow Transplant57, 156–159 (2022). https://doi.org/10.1038/s41409-021-01463-y
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/myxb/30803.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫