近期,国际顶级期刊NEJM(《新英格兰医学杂志》)上发表的一种新型免疫疗法TCR-T疗法引起轰动!一种新型的“活”的免疫疗法缩小了一名患有胰腺癌的女性的肿瘤,病灶消失达72%,研究人员认为它有可能使数百万人受益。

这项研究之所以在医学界引起轰动,是因为目前大约90%的胰腺癌存在KRAS突变,其中最常见的亚型就是KRAS G12D,占到了41%!而针对这一具有特异性靶点的庞大患者群体,目前没有任何靶向药物获批!
现在,研究人员专门研发了靶向KRAS G12D的TCR-T疗法,将对胰腺癌大部分患者群体带来治愈的新希望。
162亿个免疫细胞进入体内后,肿瘤缩小72%
这是一位72岁的女性患者(CRI-4483),也是全球首位获益的晚期胰腺癌患者。
2018年,67岁的M女士因为胰腺炎反复发作最终被确诊为胰腺癌。由于发现较早,在进行了新辅助化疗、手术、术后放化疗联合治疗后,她得到了缓解。
然而不到一年,癌症就扩散到了她的肺部,医生告诉她,唯一的选择就是继续化疗。想想痛苦的经历和最终还是会进展的结局,她拒绝了。
2020年,她参加了匹兹堡大学医学中心的肿瘤浸润淋巴细胞治疗临床试验,申请参加了一种全新的免疫细胞疗法——TILs治疗,但不幸的是6个月后,病情仍然出现了进展。
2021年6月,就在M女士心生绝望的时候,实验室的Leidner博士告诉她FDA批准了一项新型免疫疗法的临床实验TCR-T,于是她抱着最后的希望参加了TCR-T疗法的临床试验。
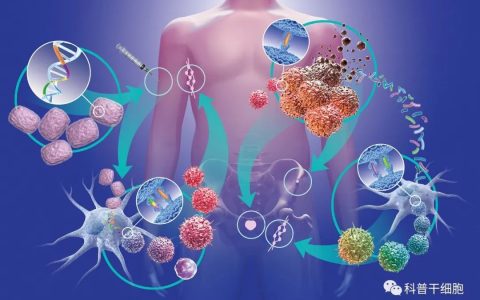
研究人员首先提取出她的T细胞,在体外进行基因改造,制备出数量巨大的、能够特异性识别她体内的KRAS G12D突变癌细胞的TCR-T细胞,再将这支能够精准杀伤癌细胞的T细胞大军回输到M女士体内。
当162亿个免疫细胞回输到M女士体内后,奇迹出现了。一个月后,M女士体内的转移灶开始消退;6个月后,经过评估,M女士的病灶竟然消失了72%!
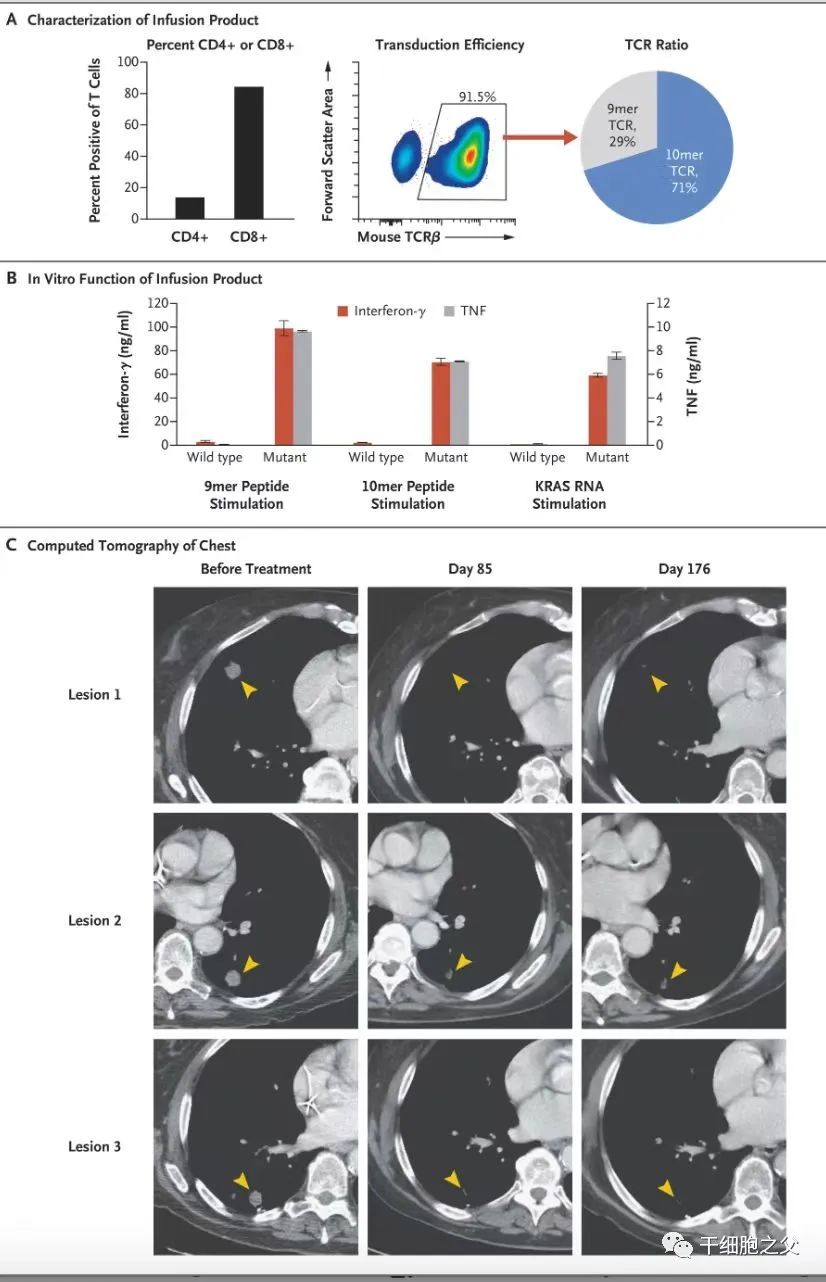
《新英格兰医学杂志》上报道说,新疗法是一种“活药”,这意味着经过修饰的T细胞会在免疫系统内继续生长和增殖,并且保持警惕以防癌症复发。这种实验性治疗成功地阻止了一名女性晚期胰腺癌的进展。
这意味着使用自身免疫细胞杀灭肿瘤将逐渐成为现实!
全新改造的TCR-T疗法挑战“癌王”
这项研究之所以在医学界引起轰动,是因为大约90%的胰腺癌存在KRAS突变,其中最常见的亚型就是KRAS G12D,占到了41%!而针对这一具有特异性靶点的庞大患者群体,目前没有任何靶向药物获批。而现在,研究人员专门研发了靶向KRAS G12D的TCR-T疗法,将给胰腺癌患者带来治愈的新希望。
简单来说,TCR-T疗法需要从患者身上获取T细胞进行改造,让T细胞表达能够有效识别肿瘤细胞的TCR(T cell receptor,T细胞抗原受体)使其能够靶向特定的癌症抗原的疗法。这种新型的疗法可以允许医生为每个患者的肿瘤和不同类型的T细胞选择最合适的靶点进行工程改造,使治疗个体化,并为患者提供更大的缓解希望。
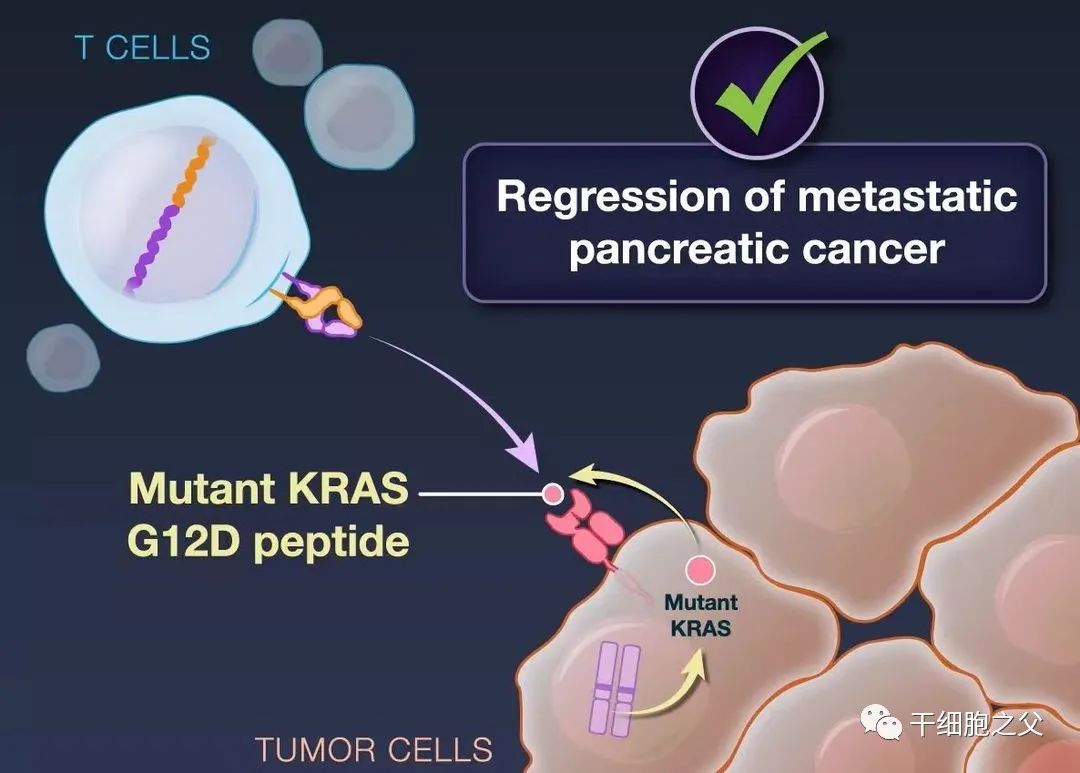
在这项实验中,研究人员将胰腺癌患者的T细胞在体外进行基因工程改造,使其表达两种不同的TCR,TCR能够识别被癌细胞的HLA蛋白呈递在癌细胞表面的肿瘤抗原。这两种TCR不仅能够精准识别包含KRAS G12D突变的多肽,而且不会对野生型的KRAS产生反应,从而能够精准靶向癌细胞。
对多种实体瘤有效!TCR-T疗法崛起!
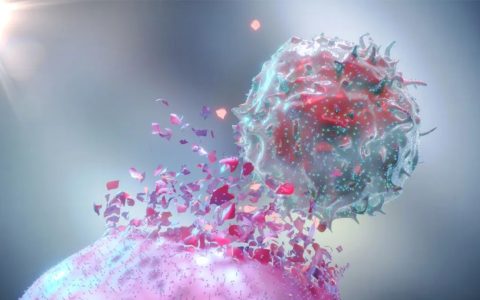
人体的免疫防御机制主要依靠体内的白细胞军团,作为白细胞的一种,T细胞有着不可替代的作用,它们是人体里面的特种兵,一旦发现癌细胞,T细胞首先主动出击,杀灭敌人,因此,它也被称为“杀手T细胞”。

大部分肿瘤患者体内没有足够能识别和杀伤肿瘤细胞的T细胞,对于这些患者,医生可以采用一种称为工程T细胞受体(TCR)治疗的方法。

TCR-T技术,即T细胞受体(TCR)嵌合型T细胞技术,也叫亲和力增强的TCR技术。它通过基因修改的方式增强肿瘤识别的亲和性,目的是让自身的杀手T细胞识别能力更强,从而实现T细胞攻击肿瘤细胞,治疗肿瘤的效果。

不仅如此,2023年1月《自然·医学》期刊上,全球知名的癌症中心-美国MD安德森癌症中心公布的新型过继性T细胞疗法,afami-cel的1期试验最新数据:在9类实体肿瘤患者,包括肺癌,胃食管交界癌,卵巢癌,头颈癌等进行实验。研究结果显示,多种治疗失败的临床上极难治疗的晚期患者,在使用TCR-T治疗后,竟能让各类癌症患者获得长期的缓解,并且有几率让患者肿瘤完全消失。
这意味着使用自身免疫细胞杀灭肿瘤将逐渐成为现实!
值得振奋的是,除了TCR-T疗法,近两年,基于T细胞的CAR-T疗法和TIL疗法也取得了前所未有的突破。
目前,三大类基于T细胞的免疫疗法已问世,唤醒体内的T细胞大军,一举歼灭肿瘤,将逐步成为现实,给癌症患者带来更多的治疗选择。
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/myxb/30638.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫