免疫疗法的巨大进展改变了目前癌症治疗的模式,然而,鉴于只有少数患者对免疫检查点阻断和其他免疫治疗策略有响应,因此需要更多新技术来破译肿瘤细胞与肿瘤免疫微环境(TME)成分之间复杂的相互作用。
肿瘤免疫组学是指利用免疫基因组学、免疫蛋白质组学、免疫生物信息学等反映肿瘤免疫状态的多组学数据对TME进行的综合研究,它依赖于下一代测序技术的快速发展。高通量基因组和转录组数据可用于计算免疫细胞的丰度和预测肿瘤抗原,然而,由于批量测序代表了异质细胞群的平均特征,因此无法区分不同的细胞亚型。基于单细胞的技术能够通过精确的免疫细胞亚群和空间结构研究更好地解析TME。此外,基于放射组学和数字病理学的深度学习模型在很大程度上有助于肿瘤免疫的研究,这些人工智能技术在预测免疫治疗反应方面表现良好。这些新技术的进展和突破对癌症治疗具有深远意义。
在过去几年中对肿瘤免疫的研究进展,使我们对肿瘤的认识发生了根本的改变。肿瘤的定义也从单纯的肿瘤细胞聚集演变为一个复杂的器官样结构,由肿瘤细胞、免疫细胞、成纤维细胞、血管内皮细胞和周围的其他基质细胞组成。肿瘤附近的各种细胞和成分,如免疫浸润细胞、血管,细胞外基质等构成的结构,也称为肿瘤免疫微环境,已成为肿瘤学最热门的研究课题之一。TME已被证明在癌症发生、肿瘤进展、转移和复发中起着决定性的作用。
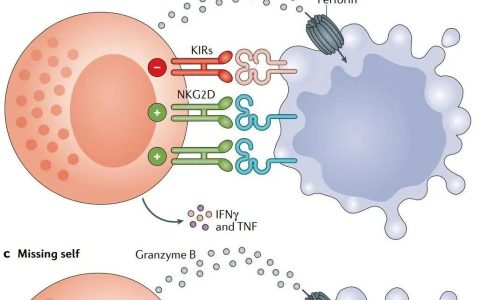
TME包含了极其多样的免疫细胞亚群,包括T淋巴细胞、B淋巴细胞、自然杀伤(NK)细胞、巨噬细胞、树突状细胞(DC)、粒细胞和髓源性抑制细胞(MDSCs)等。通常,T细胞、B细胞、NK细胞和巨噬细胞有助于抑制肿瘤生长,而MDSC和调节性T细胞(Treg)倾向于抑制抗肿瘤免疫。然而,现有研究已经证实,鉴于与肿瘤细胞的复杂相互作用,免疫细胞的特定作用可能会发生动态变化,甚至变得完全相反。
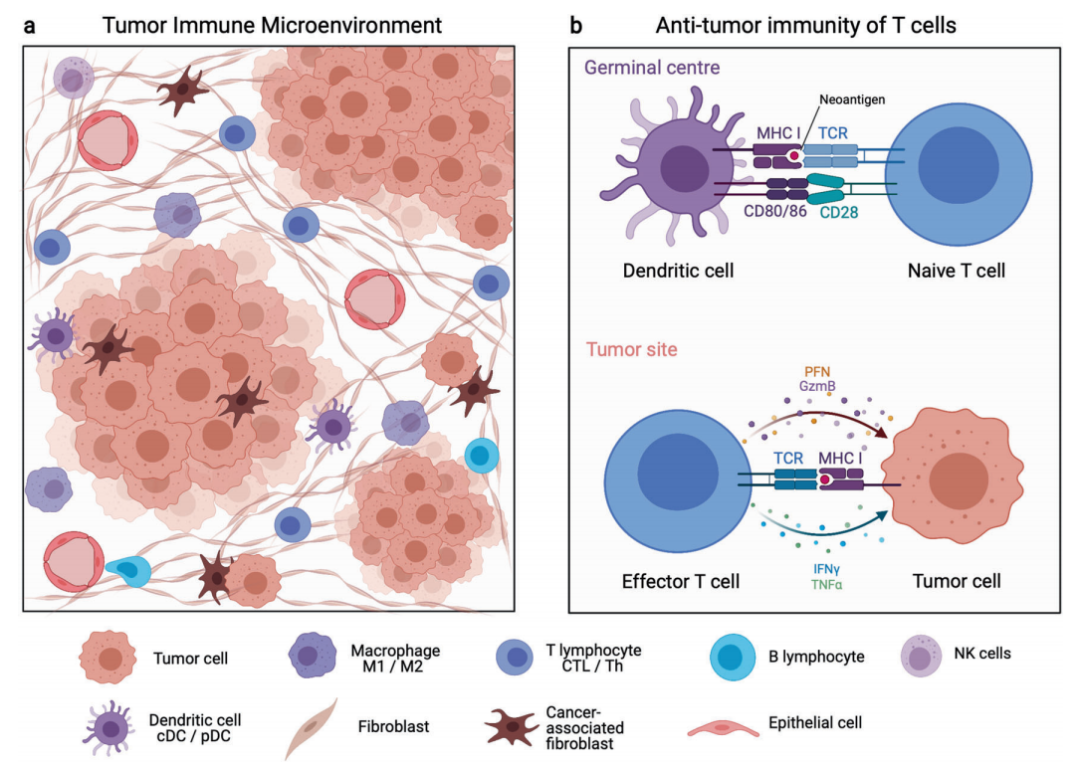
总之,各种各样的免疫细胞类型,甚至特定免疫细胞类型的不同功能状态都可能对抗肿瘤免疫产生截然相反的效果。因此,这就需要借助最先进的生物信息学技术,从而在最大程度上系统地描述肿瘤的免疫学特征,并提供更多的信息来增强我们对肿瘤免疫的理解。
在过去二十年中,包括全基因组测序(WGS)、全外显子组测序(WES)和RNA测序(RNA seq)在内的NGS已成功开发并应用于获取人类全基因组信息。NGS产生高通量基因组和转录数据,为研究多步免疫应答奠定了基础。
量化TME中的免疫细胞
TME由多种免疫细胞组成,对于肿瘤免疫细胞组分的定量,传统的方法,如流式细胞术和免疫组织化学(IHC),由于其高成本和低组织可用性,不适用于大规模分析。随着NGS的快速发展,我们能够通过NGS数据估计几十种免疫细胞类型的丰度,这些数据也被证实是可靠的。这些分析的来源主要是DNA和RNA测序,尤其是后者。关于RNA序列数据,计算方法的原理主要分为基因集富集分析(GSEA)和逆卷积。
通常,基于GSEA的代表性算法包括ESTIMATE、xCell和MCP计数。基于GSEA的方法的一个共同特点是需要为每个感兴趣的免疫细胞亚群建立特定的基因集。细胞成分的逆卷积是基于基因表达特征的体组织中细胞亚型卷积的反向过程。基于逆卷积的工具包括decornaseq、PERT、CIBERSORT、TIMER、EPIC、quanTIseq和deconf.
肿瘤抗原的鉴定
体细胞DNA突变,包括单核苷酸变异(SNV)和插入和缺失(INDEL),是异常抗原的主要来源。目前,基因组分析工具包(GATK)是通过分析WES、WGS和RNA序列数据来识别SNV和INDEL的行业标准。其范围也在扩大,以涵盖拷贝数变异(CNVs)和结构变异(SVs)。
此外,异常肽需要与HLA结合,以协助T细胞受体(TCR)识别,从而引发免疫反应。预测HLA分型对于识别肿瘤抗原至关重要。HLA miner和Seq2HLA是用于从NGS数据进行HLA分型的两种早期工具,PHLAT、HLAreporter、SNP2HLA、HLA-HD、optype和HLA-VBSeq在不同癌症中的四位、六位和八位分辨率表现都相当出色。在这些工具中,Polysolver是目前使用低覆盖率WES数据的公认标准工具之一。
除了识别异常肽和HLA分型外,抗原MHC结合亲和力是肿瘤抗原预测的下一个重点。许多肽-MHC-I(pMHC-I)亲和力预测工具是基于人工神经网络(ANN)训练方法和位置特异性评分矩阵(PSSM),如目前广泛使用的工具NetMHC和NetMHCpan。而由于MHCII结合肽长度的多样性和结合区的“开放性”,预测pMHC II亲和力更具挑战性,可用的pMHC II亲和力预测方法的数量远远少于pMHC-I。
尽管利用NGS技术研究肿瘤免疫的研究极大地促进了肿瘤学的发展,但批量测序可能会导致信号稀释到检测限以下,并掩盖单个细胞的反应。这可能会掩盖许多重要的生物学现象。直到最近,单细胞相关方法的技术突破彻底改变了我们对肿瘤免疫的理解,并将研究水平从区域水平过渡到单细胞水平。
多色流式细胞术
多参数分析在功能上和物理上区分不同免疫细胞亚群的能力已促使流式细胞仪发展为常规使用的8参数流式细胞仪。此外,随着技术的进步,可以测量更多参数的仪器设计已经实现,例如30参数和50参数流式细胞仪。然而,由于更可测量的参数精度较低,或更高精度可测量的参数有限,特别是由于荧光染料发射光谱之间的重叠,这些缺点在一定程度上限制了多色流式细胞术的应用和进一步发展。
质谱流式细胞术
质谱是该领域的一项最新创新,也称为飞行时间(CyTOF)流式细胞仪,将流式细胞仪与质谱仪相结合。与传统流式细胞仪相比,质谱仪用金属同位素而不是荧光团标记抗体,然后使用飞行时间检测器对信号进行量化,该检测器可检测至少40个参数,并避免光谱重叠问题。CyTOF已被证实是一种精确的肿瘤组织高维分析方法,用于探索性免疫分析和生物标记物发现。
虽然从理论上讲,质谱流式细胞术允许我们检测每个细胞最多100个参数,但处理速度和通量受到离子飞行的限制。在雾化和电离后,细胞在预处理过程中被完全破坏,导致后续细胞分类应用不可行。此外,关于测量某些低表达分子特征,CyTOF可能因其低灵敏度而不合适。
光谱流式细胞术
光谱流式细胞术是促进传统流式细胞术功效的另一项最新技术进步。与质谱仪不同,光谱流式细胞仪仍然用荧光染料标记抗体,但用色散光学和测量全发射光谱的新型探测器取代了传统光学和探测器。基于相同的原理,传统的流式细胞术和光谱流式细胞术保持了相当好的兼容性,特别是在商业抗体的可用性方面,但可以更好地消除混淆因素,如光谱重叠,以提高效率。随着补偿技术的发展,光谱流式细胞术有可能取代多色流式细胞术。
单细胞RNA测序
基于流式细胞术的技术将特定标签与相应的细胞亚群结合并识别该标签,表明必须在样本采集之前确定目标,而最初的目标限定限制了从这些技术中获得的信息,只能通过这些技术找到“已知的未知的”。
单细胞测序技术的出现将单细胞领域推向了新的高度。不再受流式细胞术等预定目标的限制,可以使用标准NGS协议对单个细胞进行测序,以获得可用于识别“未知”的无偏多组学分析。
目前,scRNA-seq的应用相对其他方法更为成熟,再肿瘤免疫治疗领域为我们提供了很多非常有价值的发现和启示。然而,微量物质放大产生的技术噪音仍然是最重大的挑战。如何分离单个细胞并保持其生物活性,如何解决放大带来的巨大技术噪音并提高灵敏度,如何以最低的价格获得最高数量的可测量基因,如何更有效地分析数据,这些都大大提高了单细胞测序的门槛,限制了它的广泛应用。
人工智能在肿瘤免疫研究中的技术进展主要涉及以下几个方面:(1)减轻了人工识别病理切片上免疫浸润的工作量;(2) 提供了一种替代技术来识别肉眼难以识别的免疫细胞亚群和空间结构;(3)提供一种非侵入性方法来预测特定患者的TME特征和对免疫治疗的反应。
基于深度学习方法的肿瘤抗原预测
破译肿瘤抗原的第一步是预测异常肽。除了识别SNV的多种算法外,最近设计的CN学习工具也被设计用于检测CNV,表现出良好的性能。关于HLA分型,Bulik等人生成了一个大型综合数据集,包括各种类型癌症组织的HLA类型和HLA肽,并公布了可用于训练完整质谱深度学习模型EDGE的数据,该模型已在非小细胞肺癌(NSCLC)患者中得到验证。此外,最近开发了两种很有前途的计算深度学习方法MARIA和MixMHC2pred,大大提高了MHC-II预测精度。
放射组学在肿瘤免疫中的应用
随着人工智能在医学影像学中的发展,影像已经不仅仅是一张图片,而是一个大规模的数字数据,使用AI技术分析成像数据的过程就是放射组学。应用于肿瘤免疫的放射组学技术主要用于识别反映免疫浸润的生物标记物,并预测ICB治疗患者的治疗反应。
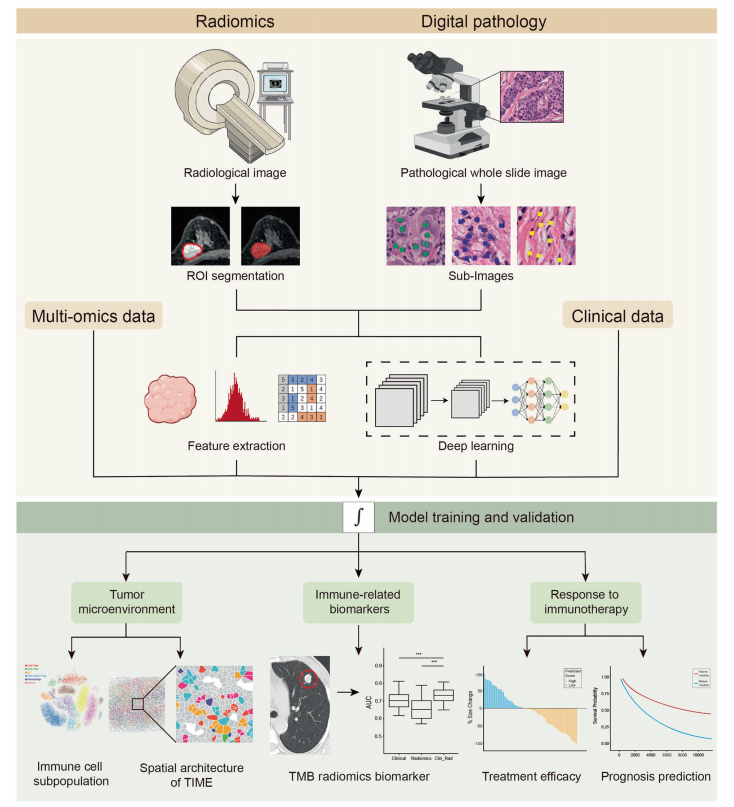
肿瘤免疫中的计算病理学
病理学中的AI,或所谓的数字病理学,通过计算分析,为探索免疫细胞和肿瘤细胞之间的相互作用以及癌症生物学关键行为之间的联系提供了新的见解。
与放射学相似,数字病理学结合深度学习从图像中挖掘出看不见的信息,使我们能够在细胞或分子水平上理解TME。数字病理学可能是研究TME结构以及癌症生物学和治疗之间关系的一种有希望的方法。
识别ICB的生物标志物用于患者分层
作为ICB的一个靶点,IHC检测到的PD-L1表达水平是第一个发现的预测性生物标记物,但一些临床试验表明ICB对一些PD-L1高表达患者仅具有轻微疗效,而ICB也会对PD-L1低表达患者有响应。因此,迫切需要其他生物标记物来填补这一空白。
2014年,研究人员首次通过WES将肿瘤突变负荷(TMB)与接受CTLA-4抑制剂治疗的患者的临床生存率联系起来。随后,其他回顾性研究也证明,高TMB与持久的临床益处相关。关于用于评估TMB的方法,由于WES的高成本和复杂性,FDA批准了两个替代NGS平台,即FoundationOne CDx(F1CDx)和MSKCC可操作癌症靶点综合突变谱(MSK-IMPACT),并通过多个癌症的前瞻性研究进行了验证。
另一方面,免疫细胞浸润,特别是TIL,在免疫反应中起着关键作用。为了发现更理想的治疗和预后生物标志物,单细胞测序被用于鉴定更多的免疫细胞亚群。已经发现TCF7+记忆样T细胞与抗PD1治疗后黑色素瘤患者的临床改善相关,而干细胞样TCF1+PD1+T细胞经证实,在ICB治疗中有助于肿瘤控制。通过单细胞测序技术,更多与治疗和预后相关的T细胞亚群和功能状态被确定。
ACT治疗中新抗原的预测
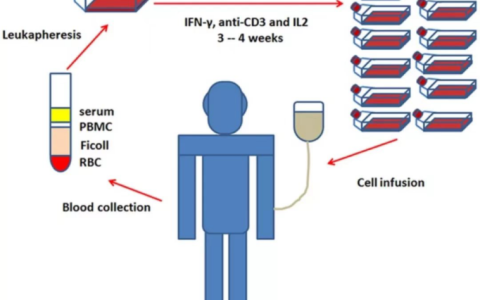
过继细胞疗法(ACT)是通过转基因或扩增的自体或异体T细胞重新回输到患者体内,以增强抗肿瘤免疫。免疫组学主要用于在ACT治疗中识别理想的肿瘤抗原。
目前,新抗原特异性TCR-T细胞尚未进入临床应用,然而,令人欣慰的是,一些病例报告显示了免疫组学预测的结直肠癌、乳腺癌和胆管癌患者T细胞识别肿瘤新抗原的有效性。Tran等人对转移性胆管癌患者的样本进行WGS,确定了26种体细胞突变。将由突变基因组成的串联微基因转录并转染到自体APC中,然后将新抗原呈递APC与患者来源的TIL共培养,最终鉴定抗原特异性CD4+Vb22+T细胞克隆,诱导上皮癌消退。
传统的基于自体APC和T细胞共培养的新抗原选择由于其低通量、高成本和耗时的特性而受到限制。为了消除这些障碍,开发了更多高通量免疫原性新抗原检测技术。Li等人建立了一个基于trogocytosis的平台,在该平台中,当TCR和pMHC结合时,表面标记蛋白就从APC转移到T细胞。因此,可以通过分析标记蛋白阳性细胞来识别理想的新抗原。未来,这些新兴的免疫基因组学技术将实现高通量新抗原选择。
为个体化肿瘤疫苗选择新抗原
免疫组学方法已广泛应用于临床研究中的疫苗开发。一般来说,用于生成个性化疫苗的新抗原是通过分析肿瘤和正常组织的WES和RNA序列,并通过算法(如NetMHCpan)预测有效表位来识别的。
与ACT相似,肿瘤疫苗开发的关键参数是理想的新抗原鉴定。为了提高新抗原预测的准确性和免疫原性新表位选择管道,免疫组学技术在这些方面做着不懈的努力。在最近的一项研究中,Wells等人汇编了所有新抗原预测和选择方法,并提供了一个全新的候选测定管道,其中包括MHC呈递和T细胞识别的14个免疫原性特征。本研究为提高肿瘤疫苗的疗效和过继性细胞治疗奠定了坚实的基础。
近年来,伴随着免疫组学领域新兴技术的巨大飞跃,我们现在能够以前所未有的深度解析肿瘤免疫。
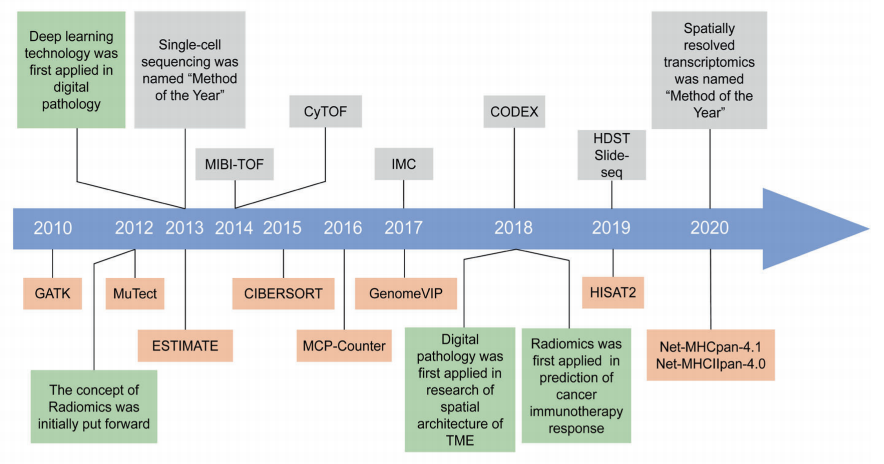
在批量测序时代,使我们能够更好地探索肿瘤免疫细胞的个体浸润模式,以及异常肽的预测、HLA分型和肿瘤抗原MHC结合亲和力的预测,使用免疫组学技术预测肿瘤抗原已在临床前和临床研究中证明了其可靠的功效。
此外,随着单细胞免疫相关技术的发展,从多色流式细胞术到CyTOF,单细胞肿瘤免疫图谱帮助我们进行免疫细胞亚群分类,以破译TME成分。人工智能的出现也为免疫组学的发展提供了新的方向。
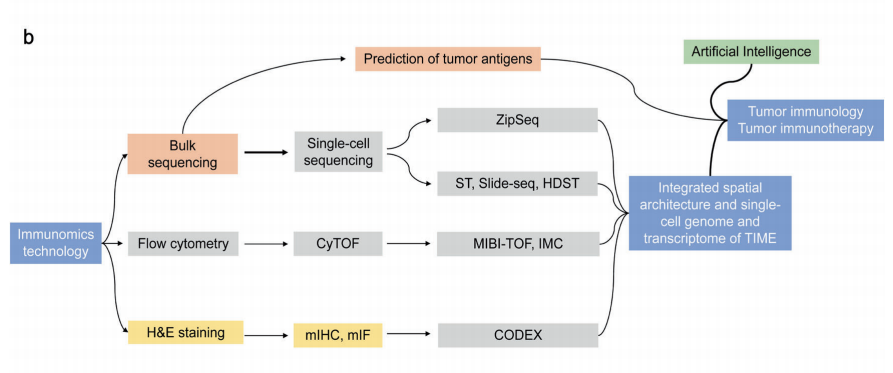
随着免疫组学技术的蓬勃发展,可持续发展需要考虑几个问题。首先,尽管已经实施了许多质量控制和改进算法原理的方法,但这些技术的有效性仍有待提高。特别是在肿瘤抗原预测、单细胞测序和空间上分辨转录组学方面,技术噪音和混杂因素阻碍了后续分析。其次,期待更具成本效益、更易获取和更自动化的技术出现,从而彻底改变学科的发展。第三,我们还期望研究人员充分利用现有技术探索肿瘤免疫,促进临床转型。
尽管还有很多工作要做,但免疫组学很可能在未来的肿瘤免疫学领域占据主导地位,其临床价值无疑将极大地促进该学科在免疫组学、单细胞和人工智能领域的发展。
参考文献:
1.Technological advances in cancer immunity: from immunogenomics to single-cell analysis and artificial intelligence. SignalTransduct Target Ther. 2021; 6: 312.
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/myxb/19187.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫