2012年,美国费城儿童医院细胞免疫疗法的先驱—Stephan Grupp博士首次探索CAR-T(Chimeric antigen receptor T-cell)治疗儿科癌症,并成功用CAR-T疗法治愈已无其他治疗手段的急性淋巴细胞白血病患者Emily Whitehead。10年过去了,Emily的白血病已痊愈(图1),Grupp表示终于可以使用“治愈”这个词来表述CAR-T的疗效。
图1 Emily Whitehead(图源:生物探索编辑团队)
Grupp(图2)表示:“我不仅仅是一名医生,我还是一名科学家。一个病例不具有说服力,现在我们已经对数百名患者进行了CAR-T细胞疗法,而且我们在这方面是独一无二的。有几十名患者已经正常生活5-9年或更长时间,不再需要进一步治疗。我们希望CAR-T能够惠及更多患者。”

图2 Stephan Grupp医生(图源:费城儿童医院官网)
CAR-T细胞疗法原理为:将从患者血液中收集的T细胞在体外扩增,并进行工程改造以表达肿瘤抗原特异性CARs,从而使生成的CAR-T细胞能够识别和攻击肿瘤细胞(图3)。CAR-T细胞疗法已显示出持久的治疗效果,并有望治愈淋巴恶性肿瘤。但是,这一突破性抗癌策略的广泛应用受到多个因素的阻碍。
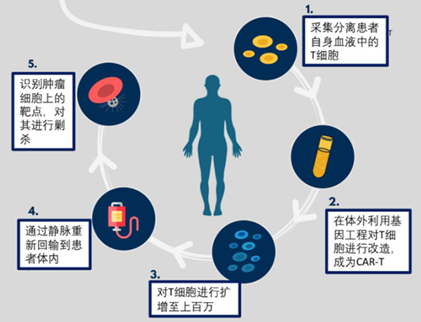
图3 CAR-T细胞疗法的工作流程(图源:费城儿童医院)
迄今为止,CAR-T治疗的患者都是用他们自己的供体,而那些接受过大量治疗的患者有时缺乏足够数量的可用于自体的功能性T细胞;再者,自体T细胞的扩增和工程化需要等待,但是一些病情严重的患者没有足够的时间;此外,CAR-T价格昂贵,国内上市的两款CAR-T疗法价格均在百万以上(药明巨诺129万/支,复星凯特120万/支);最后,CAR-T细胞在体内复制能力差,持久性弱。因此,这种高效但繁琐、劳动密集且昂贵的疗法仍然不能广泛使用。如果CAR-T疗法要惠及普通病患,那么需要另一种更容易获得的CAR-T细胞来源。
人类诱导多能干细胞(iPSC)是用于细胞治疗的可扩展制造的理想CAR-T细胞来源。iPSC细胞具有无限增殖能力,可以分化成身体所有特化的细胞类型,可以制造临床规模数量的具有所需抗原特异性的T细胞。iPSC可以进行基因改造,使其具有增强的特异性和效应功能,在体外产生大量分化程度较低的肿瘤抗原特异性T细胞,实现体内回输后的高持久性。因此,将人类肿瘤抗原特异性T细胞重新编程为iPSC,然后再分化为T细胞系具有产生恢复性肿瘤抗原特异性T细胞的潜力。哈佛医学院:利用IPSC规模化生产CAR-T,可治愈更多患者先前的研究已经表明使用人类iPSC生成T细胞用于过继性T细胞治疗的可能性,但是iPSC-CAR-T细胞发育成熟度低。最近的研究表明当使用从携带高效重排T细胞受体(TCR)或结合类器官或胸腺培养系统的T细胞来源产生的IPSCs时,T细胞成熟度增强。因此,为了实现广泛的基于iPSC的过继性T细胞疗法,需要能够高效无基质产生功能齐全、发育成熟的iPSC-T细胞的方法。
2022年8月4日,哈佛医学院和波士顿儿童医院研究团队在Cell Stem Cell发表题为“EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity”的研究成果(图4)[1]。研究结果表明通过组蛋白甲基转移酶(EZH1)抑制的表观遗传重塑,可使人类诱导多能干细胞(iPSC)高效生产发育成熟的T细胞,用于过继性细胞免疫治疗。

表观遗传调节因子在最终造血和淋巴细胞发育过程中起关键作用。组蛋白甲基转移酶(EZH1)是多梳抑制复合物2(PRC2)的组成部分,是胚胎造血发育过程中淋巴组织形成的关键负调节因子。在此项研究中,研究人员假设敲除EZH1基因会诱导iPSC在体外分化成发育成熟的T细胞。为此,研究人员对iPSC细胞进行重编程,敲除了EZH1基因,并在无基质无血清系统中衍生出iPSC-T细胞(EZ-T细胞);随后,EZ-T细胞表达anti-CD19,并被注射入患B细胞淋巴瘤的小鼠体内,以评估EZ-T细胞的持久性和肿瘤清除效率(图5)。
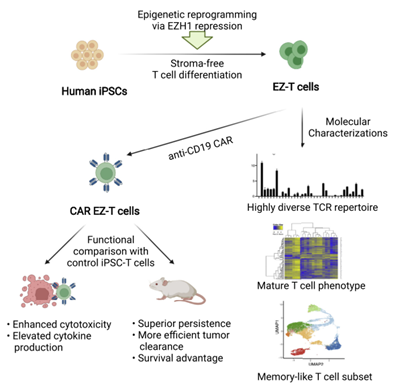
IPSCs可在无血清、无基质的系统内高效分化为表达不同TCRs的T细胞
研究人员首先将人红细胞来源的IPSCs(细胞系1157)诱导形成类胚体,以产生具有造血潜力的血源性内皮(HE)细胞;收集CD34+ HE细胞,单层种植在涂有Notch Delta样配体4(DLL4)和VCAM-1的组织培养皿上;在SFEMII培养液中加入多种细胞因子(SCF、Flt3、IL-7、IL-3、TPO)培养HE细胞,以启动T细胞分化;在此期间,HE细胞经历了内皮向造血细胞的转变(EHT),产生了含有CD5+CD7+ T细胞前体(Prots)的浮动细胞;在第14天,收集漂浮的造血细胞,在新的DLL4包被的平板上复制,然后用Flt3和IL-7培养3周;Prot细胞继续扩张并经历短暂的CD3+ CD4+未成熟的CD4单阳性(Isp)阶段,然后激活CD8的表达形成CD4+CD8+双阳性(Dp)细胞(图6)。
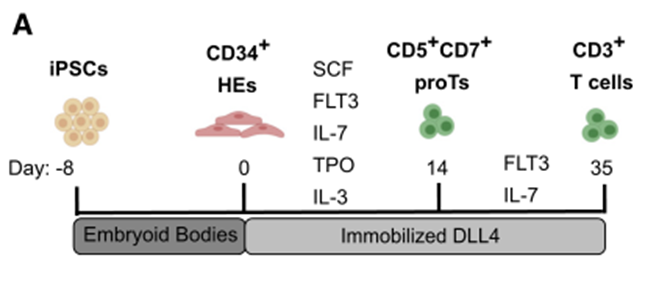
分化5周后,检测到CD3+ TCRαβ+T细胞。在抗CD3/CD28抗体和IL15存在的情况下进一步培养这些细胞,有助于诱导出单一阳性(SP)细胞。在第6周,大多数细胞表达CD3,其群体由DP和CD4/CD8 SP T细胞组成。无基质方案导致CD3+ T细胞产量显著增加。与OP9-DL1共培养相比,无基质系统还导致了更有效的T细胞特异性分化,表现为T细胞比例的增加和非淋巴样细胞频率的降低。
为了确定无基质分化是否伴随着正常的TCR重排,研究人员从无基质的IPSC-T细胞中提取基因组DNA,并对TCRb基因的互补决定区3(CDR3)进行测序以描述TCR谱系。免疫序列分析在VB家族基因的使用上发现了数以万计的具有高度多样性的独特重排,证明了CDR3在IPSC-T细胞中的随机重组。综上所述,研究人员通过建立一个无间质系统,促进正常T细胞的发育,以产生具有高度多样化的TCR谱系的IPSC-T细胞。为了确定抑制EZH1是否会促进IPSC在体外向T细胞分化,研究人员在IPSC来源的CD34+ HE细胞的T细胞分化过程中进行了shRNA介导的EZH1基因敲除。然后,通过无基质系统诱导EZH1基因敲除的HE细胞分化为EZ-T细胞,并与如上获得的对照IPSC-SF-T细胞进行比较。EZH1基因敲除使分化2周后活细胞增加2倍,6周后CD45+造血细胞中T细胞比例增加,每个起始CD34+细胞产生的T细胞绝对数增加,提示T细胞分化的特异性和效率提高。在来自不同供者的不同重编程策略的多个IPSC系中也获得了类似的结果,表明EHZ1基因敲除介导的T细胞分化的促进不受细胞系的限制(图7)。
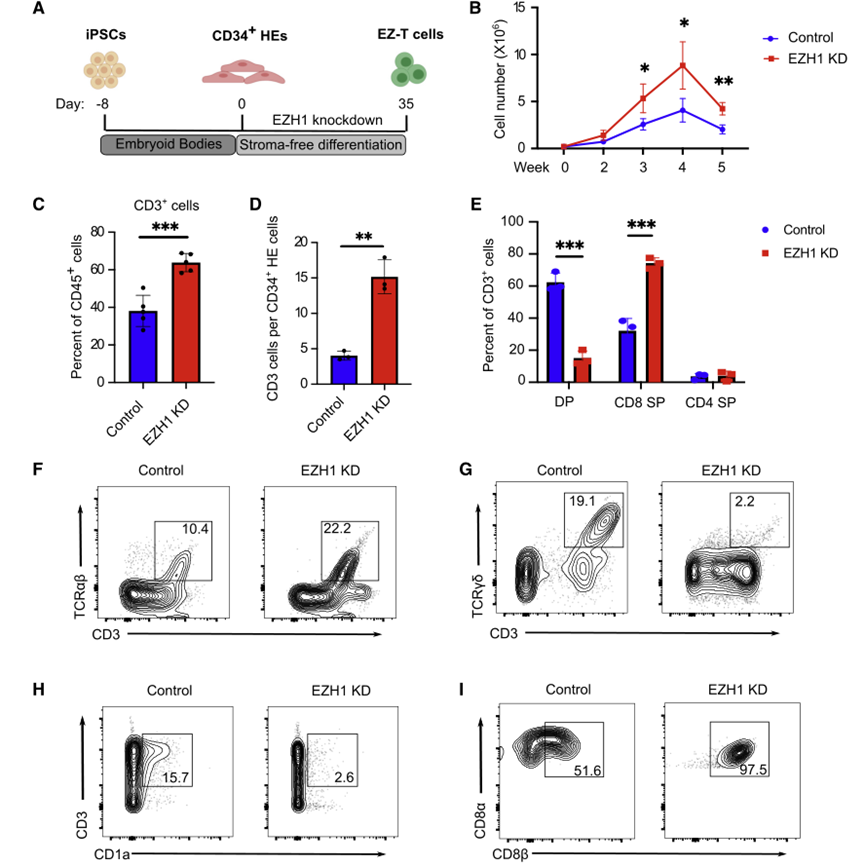
图7 EZH1敲低促进iPSC的体外T细胞分化(图源:[1])
作为shRNA介导的EZH1基因敲除的替代方案,研究人员将多西环素诱导的CRISPR干扰(CRISPRi)构建到IPSC来源的CD34+ HE细胞中,以转录抑制EZH1的表达。在T细胞规范期间(0-2周),CRISPR介导的EZH1基因敲除导致CD3+ T细胞的产生显著增加,而在Prot细胞形成后(2-5周)诱导EZH1-CRISPRi未能促进T细胞分化。在对照细胞中,EZH1的表达在HE进入Prot细胞期间显著增加,并在Prot阶段后下调。EZH2是EZH1的同源物,同样作为PRC2复合体的催化亚单位,在对照和EZH1 shRNA处理的细胞中,在T细胞分化的后期都高度表达。这一观察结果与先前的发现一致,即EZH1而不是EZH2在HE细胞中发挥抑制淋巴系承诺的功能,并解释了为什么抑制EZH1对T细胞分化的后期阶段没有影响。分化6周后,对照组IPSC-SFT细胞含有相当比例的DP T细胞,而EZ-T细胞主要由CD8或CD4SP细胞组成。
EZ-T细胞分化后CD3+TCRαβ+显著增加,CD3+TCRγδ+T细胞显著减少,表明EZH1基因敲除促进了向αβ T细胞的分化,而不是γδ T细胞。EZH1基因敲除也导致CD1a减少,CD1a在胸腺细胞中表达,但不表达在成熟的外周血T细胞中,进一步表明EZ-T细胞表现出更成熟的T细胞表型。无基质分化方案支持CD8αβ T细胞的产生,EZH1基因敲除促进了CD8αβ T细胞的更高产量,几乎检测不到先天类似CD8αα T细胞的数量。总之,这些分析表明,抑制EZH1促进了IPSC细胞在体外有效地分化为成熟的SP T细胞。EZ-T细胞表现出与外周血TCRαβ T细胞相似的分子特征CellNet对RNA-seq基因表达谱的分析表明,IPSC来源的T细胞与从外周血单个核细胞(PBMC)分离的供体来源的T细胞具有高度的相似性,并与分化较低的多能HSPC有明显的区别;检测T细胞特征基因的表达,发现通过无基质方法分化的没有EZH1基因敲除的IPSC-T细胞(PSC-SF-T)比通过OP9-DL1基质分化的IPSC-T细胞与CB-HSPC来源的T细胞更相似;对所有细胞类型的这些基因的表达水平进行了测定,结果再次表明EZ-T细胞表现出与αβT细胞最相似的基因表达谱(图8)。
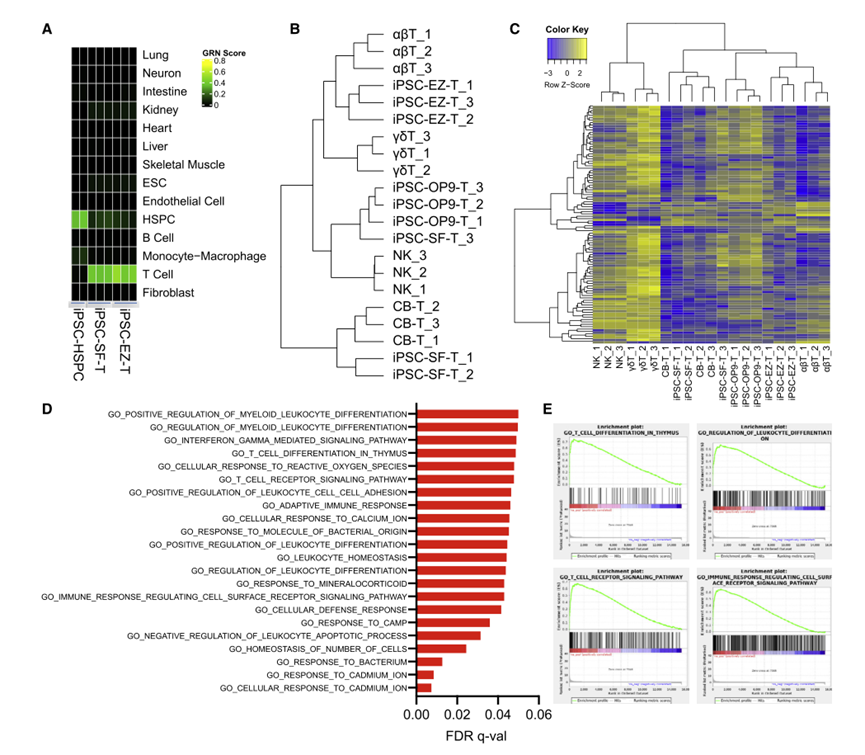
图8 EZ-T细胞显示成熟TCRab T细胞的分子特征(图源:[1])
为了探讨EZ-T细胞成熟表型的分子机制,对EZ-T细胞中最显著上调的基因进行了基因集浓缩分析(GSEA),并观察到这些基因与T细胞分化或功能直接相关的过程在生物学上高度丰富。在对照IPSC-SFαβT细胞和EZH1基因敲除的细胞之间有相对少量的基因差异表达。具有EZH1基因敲除的TCRαβ T细胞更丰富地表达TRAC、TRBC2、CD2和CD7,并显示出更大程度的下调残基(TRDC、KLRB1)。总的来说,在体外IPSC分化过程中抑制EZH1促进了表现出更成熟表型的αβT细胞的产生。在IPSC分化过程中,EZH1基因敲除促进了T细胞的成熟,由此产生的EZ-T细胞表现出与外周血TCRαβ T细胞最相似的分子特征。iPSC衍生的EZ-T细胞重现了原始T细胞的分化,产生了表现出记忆样表型的效应细胞和T细胞亚群。CAR EZ-T细胞在体外和体内显示出增强的抗肿瘤活性当用抗CD19 CARs进行工程设计时,EZ-T细胞在体外和体内均比缺乏EZH1敲除的对照iPSC-SF-T细胞产生更好的抗肿瘤效果(图9)。
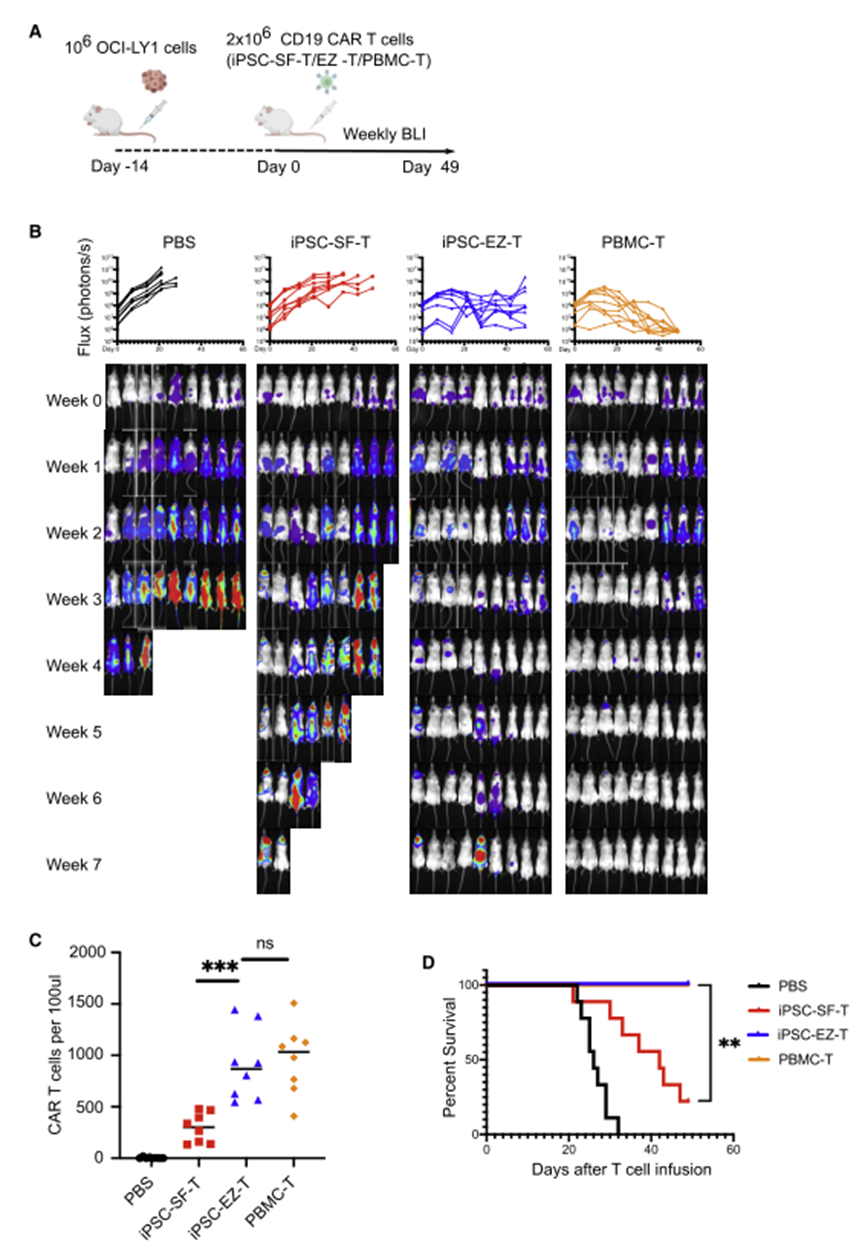
图9 CD19 CAR EZ-T细胞介导更强大的体内肿瘤清除(图源:[1])
iPSC细胞衍生的T细胞被进一步转化为CAR-T细胞时,其所显示出的抗肿瘤活性与目前用于临床疗法的方法所产生的CAR-T细胞的抗肿瘤活性相当,当与此前iPSC细胞方法所制造的T细胞相比,这些新细胞在实验室中杀灭癌细胞和清除活体小鼠癌细胞的能力都有所增强。
研究作者Daley表示:“经过多年的研究,如今我们发现iPSC细胞最终或能帮助开发用于治疗诸如癌症等多种人类疾病的新型疗法。通用型的iPSC细胞不仅能被有效转化为CAR-T细胞,而且还能有效制造出一种增强型的CAR-T细胞,其能更加类似于目前使用的金标准临床级的细胞,这种新型策略或许就能实现现成的CAR-T细胞疗法且帮助更多患者及时有效地进行治疗。虽然iPS细胞在理论上是不同细胞类型的无限来源,但研究人员必须克服衍生出成熟且功能齐全的T细胞所遭遇的挑战,这些细胞就能帮助制造出CAR-T细胞;过去,由于iPS细胞在培养皿中更容易产生不成熟的细胞,因此研究人员一直在努力解决这个问题。”



















 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫