糖尿病一直是影响世界的公共卫生问题。据国际糖尿病联合会(IDF)最新统计,至 2019 年,全球糖 尿病患者已有 4. 63 亿,患病率高达 8. 3%,预计到 2030 年,世界糖尿病发病人数将达到 5. 78 亿,至 2045 年将达 7 亿。2019 年,中国有 1. 16 亿糖尿病患者, 患者人数居世界首位。根据 2013 年我国慢性病及其危险因素监测结果,18 岁及以上人群 2 型糖尿病 (T2DM)患病率为 10. 4%。
处理糖尿病是许多人的日常斗争。它可能需要几乎不断地预先考虑一个人白天什么时候吃什么,是否需要以及需要多少胰岛素,无数次手指刺以检查血糖水平,以及不断携带胰岛素和测试仪,这些带来的额外不便以及他们度过这一天所需的一切可能伴随终生。
糖尿病
糖尿病是指身体无法有效产生或使用胰岛素的一系列疾病,胰岛素是将食物转化为能量所需的激素。糖尿病的原因尚不清楚,到目前为止,还没有治愈方法。糖尿病是当今美国第七大死亡原因。
糖尿病主要分为三种类型:
1型是一种自身免疫性疾病
2 型与遗传和生活方式风险因素有关
妊娠糖尿病发生在怀孕期间
稳定胰岛素水平是控制糖尿病的关键。今天的标准治疗侧重于补充身体的胰岛素,通常是通过注射(针头)或胰岛素泵,佩戴在体外。这需要患者每天多次测试他或她的血糖水平,并仔细维持血胰岛素水平。虽然这被认为是目前最好的护理标准,但研究人员希望找到一种方法来帮助身体产生或更好地调节自身的胰岛素水平。
正在研究的一种方法是使用干细胞在胰腺中产生产生胰岛素的胰岛。虽然干细胞疗法尚未治愈 1 型糖尿病,但有记录表明患者已经多年无需注射胰岛素。一些临床试验正在使用脐带血干细胞专门治疗糖尿病。
干细胞治疗 II 型糖尿病
2020 年,研究人员收集并分析了 2010 年至 2020 年间发表的 13 项研究,其中 342 名患者接受了脐带血中丰富的干细胞,另外 111 名患者接受了脐带组织中丰富的干细胞治疗糖尿病。虽然不是每个人都对治疗有反应,但研究人员观察到血糖控制得到改善,对胰岛素的依赖减少,持续时间长达四年。虽然结果显示了使用干细胞治疗糖尿病的前景,但仍有一些问题没有得到解答,包括谁是理想的候选者、最佳给药途径是什么、最佳剂量是多少以及是否需要多次输血。
巴西治疗 I 型糖尿病的研究
在巴西进行的一项包括 21 名成年 1 型糖尿病患者的临床试验表明,干细胞输注可以治愈这种疾病,至少可以持续数年。2019年发表在《免疫学前沿》杂志上的结果显示,大多数患者在三年半的时间内不再使用胰岛素,而一名患者在八年内不必使用胰岛素。“我们现在了解到干细胞移植可以成功治疗某些糖尿病,”Chan Soon-Shiong Shapiro 糖尿病杰出主席、糖尿病免疫学系教授/创始主席和监测员 Bart Roep 博士说。

Bart Roep, Ph.D.
“我们发现了预测这些结果的免疫特征——无论是有利的还是不利的——这是迈向 1 型糖尿病个性化医疗的第一步,”罗普博士说。“了解为什么它有时会失败将使我们能够为那些不幸的患者设计新的治疗策略。此外,这是 T1D 可以治愈的第一个明确证据。”
在研究中,1 型糖尿病患者在不使用胰岛素的情况下输注后持续了长达 30 个月;然而,在那之后,获益开始减少,大多数长期不使用胰岛素的患者最终恢复使用胰岛素。这表明可能有其他机制在起作用,或者遗传背景可能仍然有影响。为了对抗这种影响,我们注入了 T 调节细胞 (Tregs)。在短期随访中,八名患者中有六名患者输注 Tregs 降低了胰岛素需求,其中两名患者不再需要胰岛素。
该研究中的干细胞是自体造血干细胞。它们与脐带血中发现的干细胞类型相同。由于 1 型糖尿病(通常称为青少年糖尿病)是一种在生命早期就出现的自身免疫性疾病,因此很容易看出这项研究的结果可以证明对出生时储存脐带血的人有益。脐带血是这些造血干细胞的最佳来源,因为它们幼稚且不存在任何由衰老引起的突变。
这项研究的结果是在同一研究人员最近得出的结论之后得出的,即 1 型糖尿病不是由免疫系统错误地攻击产生胰岛素的 β 细胞引起的,而是由受到影响的 β 细胞本身影响免疫反应引起的。
间充质干细胞(MSCs)治疗糖尿病的机制
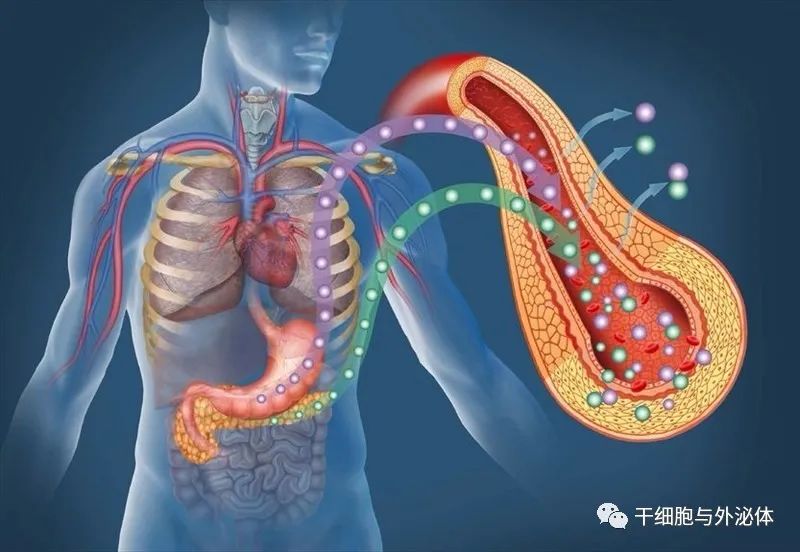
糖尿病是一种绝对或相对胰岛素缺乏导致的以 慢性高血糖为特征的代谢性疾病,其中 T2DM 占比 90%~95%。目前治疗药物包括磺脲类、双胍类、α 葡萄糖苷酶抑制剂、DPP-Ⅳ抑制剂、SGLT-2抑制剂、 GLP-1受体激动剂、胰岛素等药物,但这些传统的治 疗方法存在各自的局限性,而且只能暂时控制血糖, 不能从根本上治愈 T2DM。MSCs 治疗糖尿病是一 种基于细胞的治疗方法,其自身的可再生、分化潜能 以及免疫抑制特性,已在 T2DM 中显示出较好的治 疗效果,为治疗糖尿病提供了新的思路及可能的发 展方向。大量动物实验及临床研究表明,MSCs 是治疗 T2DM 的新方法,其可能机制 包括:①逆转 β 细胞 去分化,从而减轻β细胞功能障碍、保护内源性胰岛 β 细胞;②干细胞移植后归巢到受损胰腺并分化为 胰岛β细胞;③向炎症微环境迁移,产生抗炎细胞因 子,减轻炎症反应,减少脂肪组织和肝脏中的脂肪含 量,增加胰岛β细胞数量;④通过内皮细胞的分化潜 能及旁分泌作用促进胰岛细胞再生;⑤改善胰岛素 抵抗;⑥分泌多种细胞因子,进一步诱导胰岛α细胞 转变为 β 细胞,减少胰高血糖素分泌增加胰岛素分 泌以降低血糖。外泌体通过 AMPK 通路激活自噬, 改善T2DM大鼠肝脏糖脂代谢,需进一步验证。
间充质干细胞治疗(MSCs) 2 型糖尿病的临床研究现状
近年来,各国学者对干细胞移植治疗糖尿病进 行了深入研究。截至 2020 年 4 月,以“ diabetes” 和 “stem cell”为关键词,检索美国 NIH 全球最大的临 床试验数据库(www. ClinicalTrials. gov),结果显示 全球范围内干细胞治疗糖尿病的临床试验共计 211 项,其中关于 T1DM 共 62 项,T2DM 共 74 项,糖尿 病并发症 85 项。
干细胞类型包括异体 UC-MSCs、 自体骨髓单个核细胞、自体或异体 BM-MSCs、自体 或异体脂肪 MSCs、异体牙髓 MSCs 等。在中国范围 内开展的干细胞治疗糖尿病病临床试验共计 39 项, 其中,使用 UC-MSCs 进行治疗研究的共 9 项,3 项 为 UC-MSCs 治疗 T2DM 的研究。
先后已有中国、美国、印度等国家报道了 MSCs 治疗 T2DM 的临床研究结果。2008 年,Jiang 等对胎盘来源 MSCs 用于糖尿病的治疗进行了探 索。研究人员以静脉注射方式将 1. 35×10 6 / kg MSCs 分 3 次注入 10 例患者体内,每次输注间隔时间为 1 个月。10 例患者于移植后 6 个月出现胰岛素需求量显著减少,减量幅度为(29±5. 3)IU,4 例患者胰岛素 减量超过 50%。平均糖化血红蛋白(HbA1c)由移植 前 9. 8%降至移植后 6. 7%,C 肽和胰岛素水平均改善 显著,所有患者术后均未出现发热、寒战、肝损伤、免 疫排斥等反应。
2010 年 5 月,Liu 等采用 UCMSCs 治疗 22 例 T2DM 患者,开展了 1 项为期 12 个 月的自身前后对照试验。该研究选用外周静脉和脾 动脉两种 MSCs 移植途径,两次移植以 5 d 为间期,共 输注 1×10 6 / kg MSCs。HbA1c 的下降程度在治疗后 3 个月时显著减缓,由移植前(8. 20±1. 69)%降低至 (6. 89±0. 90)%;空腹血糖在 MSCs 移植后不同监测 时间点均有不同程度下降,在 6 个月时差异最为显 著,并在 12 个月随访期内维持在较低水平。口服葡 萄糖耐量试验(oral glucose tolerance test,OGTT)2 h 血糖在术后 1 个月达到最低。空腹 C 肽在术后 1 个 月开始增加,并在 6 个月时达到峰值。HOMA-2B (homeostasis model assessment)从移植前的(65. 99± 23. 49)%增加至 6 个月时的(98. 86±43. 91)%,在 12 个月随访期恢复至(86. 0±37. 1)%。所有需使用胰 岛素的患者注射剂量均较移植前显著减低,并在 12 个月内维持较低水平;29%(5 / 17)患者胰岛素注射 剂量减少超过 50%;41%(7 / 17)患者在术后 2 ~ 6 个 月停用外源性胰岛素,达到完全缓解状态并平均维 持(9. 3±3. 8) 个月。此外,5 例口服降糖药的患者 中,有 1 例停用口服降糖药。
间充质干细胞移植治疗 2 型糖尿病的临床研究结果
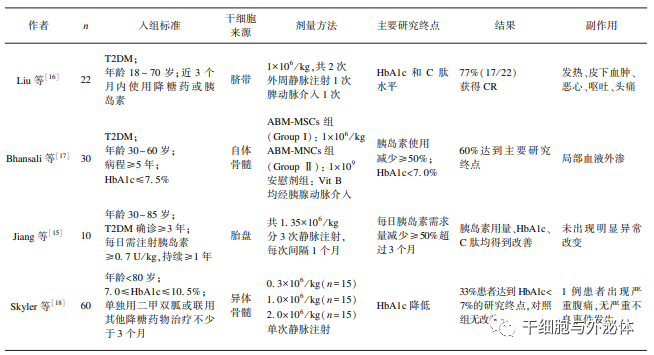
已开展的动物实验及小样本临床研究观察到 MSCs 移植可改善 T2DM 动物的胰岛 β 细胞功能, 降低 T2DM 患者的胰岛素用量,改善 HbA1c 水平以 及 C 肽分泌,为糖尿病患者血糖控制提供了一种治 疗新策略。
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/8166.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫