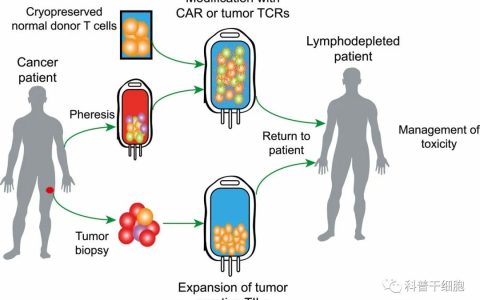
“ 肌肉萎缩症是一类因不同病因而导致肌肉力量减退的疾病,其中Ullrich型先天性肌肉萎缩症(UCMD)作为COL6相关肌病的末端终结,不光会剥夺患者的行动力与智力,严重时还会危及患者生命。 幸运地是,这个“不治之症”正在被攻克,日本京都大学iPS细胞研究与应用中心(CiRA)发现:利用基于iPSC技术衍生的间充质干细胞(MSCs)能恢复先天性肌肉萎缩症小鼠的肌肉再生,为疾病的治疗带来了新的方案。

皮肤下的肌肉可能是最为神奇的人体引擎。
它支持着我们走路、跑跳,甚至攀登上陡峭的山峰。也正是这600余块肌肉的紧密合作,我们的日常行动才得以为继。
然而有这么一群人,从出生就被剥夺了行动的权利,他们患上了一种叫“Ullrich型先天性肌肉萎缩症(UCMD)”的罕见病,是由人体编码胶原蛋白Ⅵ(包括COL6A1,COL6A2和COL6A3)发生基因突变所导致的。
患儿从小就会出现肌无力,无法独立行走等问题,待到年龄渐长,他们还得依靠呼吸机维持夜间呼吸,否则极易因呼吸衰竭而死亡。
更令人绝望的是,作为最严重的COL6相关肌病,医学界对此也束手无策,难道只有眼睁睁地看着疾病愈演愈烈吗?
11月23日,国际期刊《Frontiers in Cell and Developmental Biology》(影响因子:6.684)给出了新答案。

△ 研究发现:干细胞促进患有罕见肌肉疾病的小鼠肌肉恢复再生
来自日本京都大学iPS细胞研究与应用中心(CiRA)的研究者[1]发现:通过iPSC衍生的间充质干细胞(iMSC),可以系统性地恢复胶原蛋白VI合成,帮助UCMD小鼠肌肉再生。这一结果为有UCMD患儿的家庭点燃了希望。
8周握力提高35% iPSC带来治疗新策略
近年炙手可热的iPSC细胞技术相信大家都有所耳闻。
这项被誉为“改变世界的伟大技术”,意味着研究人员可以用机体的多种不同来源的细胞进行重新编码,将它们转化为具有万能分化性的诱导多能干细胞(iPSC),进而分化成干细胞、神经细胞、或者是其他需要再生的细胞。
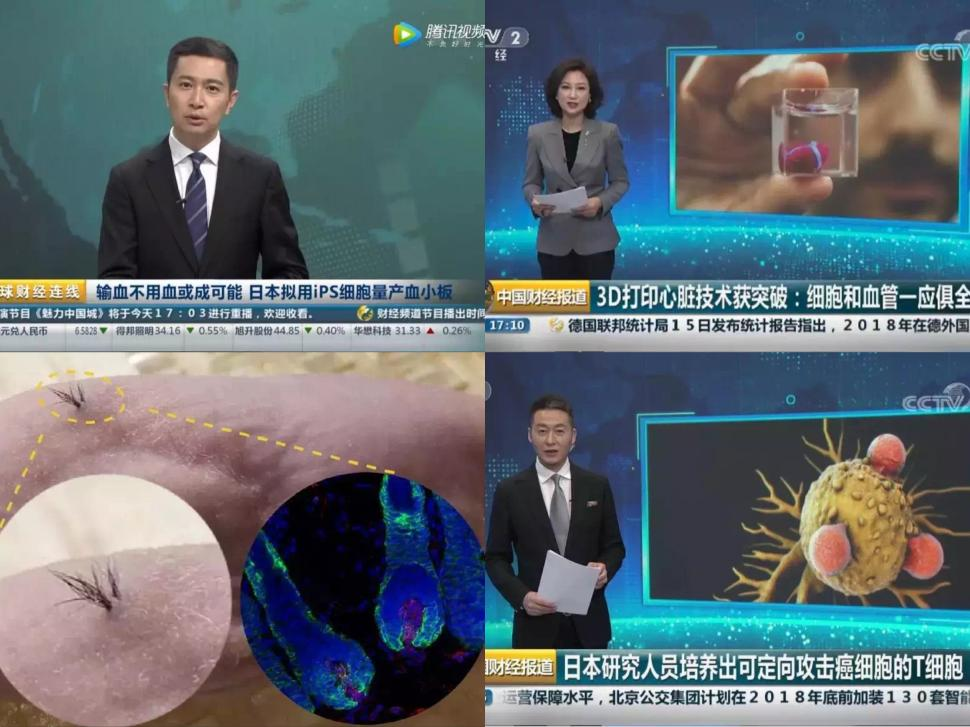
△iPSC技术正在改变世界。它能量产血小板(左图上),支持3D打印心脏(右图上)再生毛囊干细胞(左图下),定向分化成T细胞(右图下)
此项UCMD实验中选用的便是iPSC技术衍生的间充质干细胞(iMSC)。
可能有人会疑问:为何不直接提取自身骨骼肌中的MSCs,反而要经iPSC技术“曲线救国”呢?
对此,该研究的Aya Harada博士是这样考虑的:“虽然源自其他组织的MSCs理论上也能产生胶原VI,但运用iPSC可以制备大量具有均匀质量的细胞用于移植。”简而言之,iPSC衍生细胞在“量产”上更具优势。
而在动物模型选择上,基于前人经验,研究者选择了在敲除Col6a1基因、获得NSG (NOD酸γ)背景后杂交获得的Col6a1KO/NSG小鼠。这些小鼠都被安排了腹腔注射5×10⁶iMSCs。部分小鼠还在第4周进行了i.p.加强移植(23G 1ml注射器注射5 × 10⁶个iMSCs )。
待到第8周进行数据统计时,研究者重点观测了这些被安排i.p.移植小鼠,追踪指标为胶原蛋白VI的挽救面积、肌肉的再生情况,同时也对线粒体形态和细胞凋亡情况,肌肉功能进行了检测,结果发现:
1、与未移植的小鼠相比,移植iMSC的小鼠在第8周肌肉重量明显增加;
2、在移植小鼠中,多核的肌纤维的数量增加且多核肌纤维与单核肌纤维的比例提高;
3、iMSC移植减少了畸形线粒体和肌肉细胞的凋亡数量。
4、8周后,iMSC移植的小鼠握力较之未移植小鼠提高了35%,旋转能力也提升近30%。
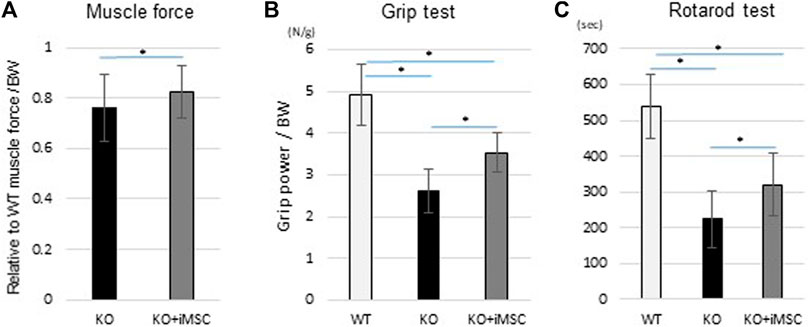
△iMSC移植小鼠在8周时旋转及握力功能均得到改善
但实验并未到此为止,为了确认iPSC衍生iMSC的安全性,在接下来的20周研究者依旧保持着观察,而直至实验结束,小鼠并未出现不良反应或致瘤事件。
综上所述,iPSC技术具有治疗UCMD的潜力。
全能分化性+抑制凋亡 iPSC起效关键
在这项研究中,iPSC技术之所以能够起效,关键还在于iPSC的全能分化性与抑制细胞凋亡的特性。
UCMD发病机制是由于编码胶原蛋白Ⅵ(COL6A1-3)上的基因发生突变,继而对胶原蛋白VI的合成、组装、分泌等产生影响。也就是说,在UCMD中,胶原蛋白VI是关键物质。
得益于iPSC细胞的全能分化特性,这群经iPSC衍生的iMSC几乎保持了和骨骼肌原始MSC相似的基因及蛋白表达水平,同样能发挥修复再生体内组织的功能。我们在随后的实验中也能看到,iMSC展现了长时间分泌胶原VI的能力,以增强胶原VI恢复部位的肌肉再生。
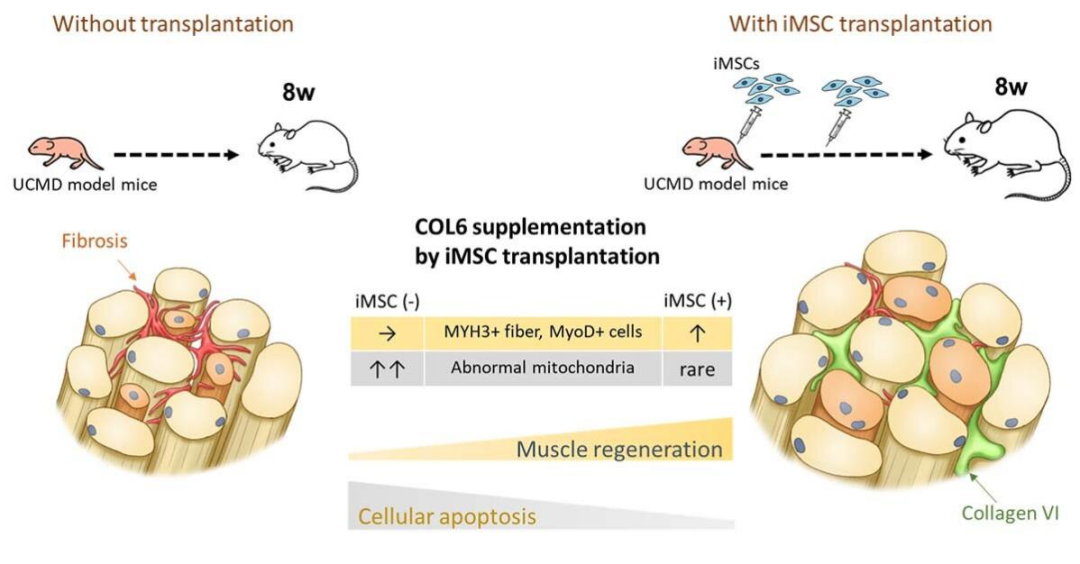
△Hidetoshi Sakurai实验室展示了iPS细胞如何补充胶原VI以再生患有Ullrich先天性肌肉萎缩症的小鼠的肌肉。图片来源:京都大学
而在实验中,UCMD小鼠的线粒体还呈现出异常状态,也由此加速了肌肉细胞的凋亡,这种情况在移植iMSC后得到了改善,这里就要说到干细胞的旁分泌特性了。

△未移植Col6KO/NSG小鼠8周四头肌的电子显微照片(A)箭头处为线粒体异常,移植iMSC小鼠线粒体(B)异常极少
大量实验证实:干细胞可以分泌各类生长因子、细胞因子,如血管内皮生长因子(VEGF),肝细胞生长因子(HGF),胰岛素样生长因子等,这些因子都能参与调节细胞微环境,防止肌肉细胞提前凋亡。
不止于UCMD
干细胞带来更多希望
前文我们就提到过,肌肉萎缩其实是一系列不同病因而导致肌肉力量减退的疾病,所涉病种十分广泛,除了上述提到的UCMD,还有进行性肌肉萎缩症,脊髓性肌萎缩等,而干细胞在它们的应用治疗上也均有建树。
脊髓型肌萎缩是一种由脊髓前角运动神经元变性导致的肌无力、肌萎缩的疾病,主要是由SMN1基因突变导致,患者主要表现为进行性、对称性四肢和躯干肌无力,萎缩,重症患儿常死于呼吸衰竭。
那干细胞疗法可以治疗吗?2012年《Science Translational Medicine》(影响因子:17.956)发表一项研究[2],意大利的科学家们从SMA患者的皮肤成纤维细胞产生并经遗传矫正的iPSC细胞用于自体细胞疗法,他们在小鼠模型中成功控制住了疾病的进展。

△经基因校正的 SMA-iPSCs 在分化为运动神经元后可能为 SMA 的治疗性移植提供运动神经元的来源
研究者之一的米兰大学Stefania Corti表示:“理想的脊髓性肌萎缩治疗方法将是一种组合治疗策略,用分子治疗解决遗传缺陷,用细胞移植补充性地应对疾病病症。”
进行性肌肉萎缩症
这个疾病案例发生在中国,CCTV-1《人口》栏目曾报道过一对患有”进行性肌肉萎缩症”的双胞胎兄弟[3]。这种肌肉萎缩也是由于基因缺陷导致的,基本无药可医。
还好母亲蔡丽萍并没有放弃希望,她偶然在电视中看到有医院正通过干细胞移植治疗疾病,就与院方取得了联系。
在经过从孩子体内抽取一定数量的骨髓干细胞,进行细胞分离,培养和诱导分化后,这些被寄予厚望的干细胞被移植回孩子体内。
结果手术非常顺利,在20天之后,双胞胎中的彬彬就可以靠墙站住,而在接下来的2年间,经过4次干细胞移植手术,两个孩子已经能走路。

△兄弟两正在接受康复训练,这将是一个漫长而充满希望的过程
干细胞这项新技术的应用让他们的症状得到缓解与好转,改善了患者的生活质量。
随着全球范围内相关研究的不断深入,干细胞已经在多种会导致肌肉萎缩症的疾病临床中展现了其威力,随着这些“不治之症”被逐渐攻克,让罹患肌肉萎缩症的病患重新站起来,过上正常人的生活,将不再是梦想。
Write in the last
写在最后
不止于UCMD,不止于肌肉萎缩相关疾病,干细胞疗法正以不可抵挡的势头挑战着多种疑难杂症,虽然再生医学之路无法一日千里,但随着探索的车轮不断向前,我们翘首以盼的明天,终将逐一实现。
部分图片来自网络
参考资料:
[1] Systemic Supplementation of Collagen VI by Neonatal Transplantation of iPSC-Derived MSCs Improves Histological Phenotype and Function of Col6-Deficient Model Mice. https://doi.org/10.3389/fcell.2021.790341
[2] Genetic correction of human induced pluripotent stem cells from patients with spinal muscular atrophy. https://doi.org/10.1126/scitranslmed.3004108
[3] CCTV-1《人口》栏目:站起来的“面条”兄弟
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/7973.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫