近日,CCTV2《中国经济大讲堂》栏目聚焦了糖尿病管理的新技术,其中提到前沿技术,包括以基因检测为基础的精准用药,以及数字可视化,比如智能可穿戴设备,此外强调对于严重的并发症,再生医学应该站在前列,干细胞让治愈糖尿病成为可能!
1998年,美国科学家James Thomson首次从人类囊胚中分离出胚胎干细胞,并成功建立了人胚胎干细胞系。自此,体外获得各种人体功能细胞成为可能,由此开启了干细胞再生医学的新时代。
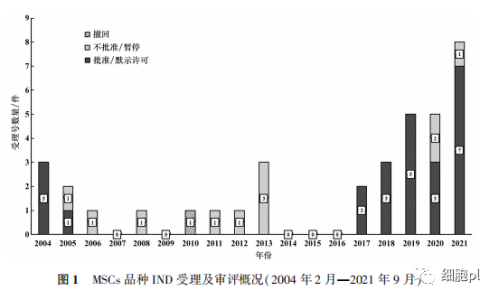
近年来,我国干细胞领域发展如火如荼,而糖尿病作为干细胞重要的应用方向,得到了极大的关注。截止2020年1月19日,据查询美国国立卫生研究院(NIH)的临床试验注册网站(clinicaltrials.gov),全球正在开展的糖尿病相关干细胞治疗临床试验共计208项,其中我国注册项目42项,主要涉及1型糖尿病、2型糖尿病以及糖尿病血管病变、神经病变、糖尿病足等并发症的治疗。
糖尿病作为一种常见的慢性疾病,威胁着越来越多人的健康。干细胞作为一种新兴的疾病治疗手段,在治疗糖尿病及其严重并发症方面也显示出巨大潜力,甚至有根本性治疗糖尿病的势头。

干细胞治疗糖尿病的机制探讨
成体干细胞移植更多的机制是, 通过其强大的旁分泌效应,实现对胰岛素抵抗和受损β细胞功能的改善。
经过进一步研究发现,MSCs可通过分泌效应作用于包括细胞自噬、巨噬细胞极化等多个环节。
体外研究显示,MSCs可显著提高2型糖尿病动物模型胰岛β细胞自噬水平,增强长期高糖环境下的胰岛细胞活性。肝脏细胞的自噬也得到显著改善,肝脏摄糖能力明显提高,合成糖原能力增强。
MSCs输注后,糖尿病动物模型胰岛、脂肪等组织中巨噬细胞极化方向发生明显变化,抗炎、促修复的M2型巨噬细胞明显增多,促炎型M1型巨噬细胞比例下降,且该效应可能涉及MCP-1(单核细胞趋化蛋白-1)和IL-6(白介素-6)的调节作用。
进一步研究发现,与HepG2细胞共培养的ADSC(脂肪来源MSCs)可作用于葡萄糖代谢酶及胰岛素信号转导相关蛋白,提高HepG2细胞的胰岛素敏感性。

干细胞是治疗糖尿病的“安全细胞”
干细胞是一种具有自我更新复制和多向分化潜能的细胞,作为再生医学的“明星细胞”,干细胞在组织重建方面具有良好的前景。
研究表明,间充质干细胞是临床应用最广泛的干细胞,它可直接分化成血管内皮细胞和皮肤组件。此外,间充质干细胞通过分泌生长因子和相关细胞因子促进伤口愈合,如表皮生长因子、碱性成纤维生长因子、血管内皮生长因子、TGF⁃β、胰岛素生长因子1及IL⁃8等,通过促进血管形成、组织再生及募集内源性干细胞,促进伤口愈合。
研究发现,干细胞在治疗糖尿病上具有明显优势。
首先,干细胞能够分化为β细胞,增加胰岛素的分泌;
其次,干细胞可以通过抑制T细胞增殖和减少炎症反应来调节免疫组效应,可以保护β细胞免受自身免疫攻击;此外,干细胞可以通过旁分泌作用分泌细胞因子,增强细胞的抗氧化和增殖能力,有助于提高β细胞的存活率。
发表在《Systematic reviews》上的一篇综述,荟萃分析系统评估了间充质干细胞和造血干细胞移植治疗I 型糖尿病的安全性和有效性。纳入的研究中有6项涉及到间充质干细胞移植,接受间充质干细胞移植的50 名患者中,5 名患者获得良好疗效,达到一段时间不需要注射胰岛素的效果;其中23 名参与者的每日胰岛素总量(TDD)降低,并且在这些患者中未观察到不良反应。Meta分析显示,间充质干细胞治疗I型糖尿病是有效的。
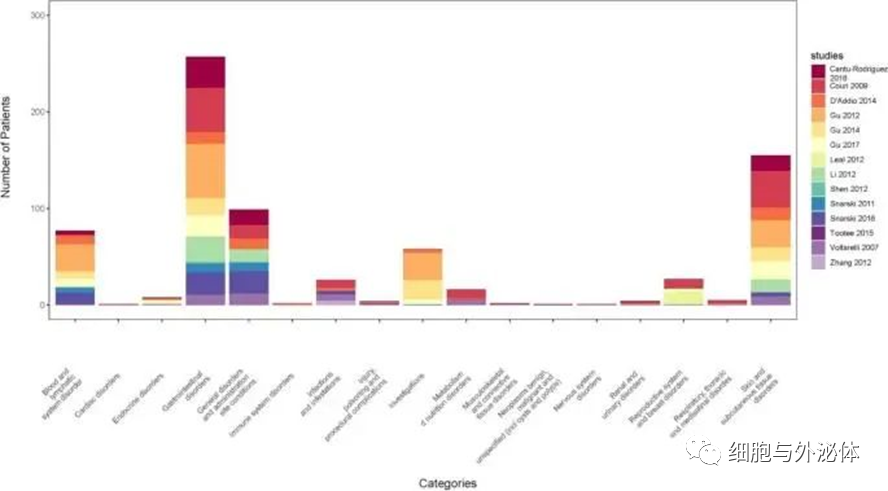
根据这项荟萃分析的结果,间充质干细胞、造血干细胞及其共同移植与I型糖尿病的改善显著相关。间充质干细胞及其与造血干细胞联合可视为I型糖尿病干细胞移植的“安全细胞”。

干细胞有望让糖尿病患者“摆脱”胰岛素
过往的研究发现,干细胞治疗后糖尿病患者多项临床指标显著改善,胰岛素用量显著减少,干细胞也被认为是“告别”胰岛素注射的新希望。近年来备受业界关注的糖尿病干细胞在研疗法VX-880,可分化成胰岛细胞,通过门静脉途径给药,然后可分泌胰岛素,从而补充1型糖尿病患者胰岛素绝对缺乏的情况[3]。2022年该疗法公布了首例接受治疗的1型糖尿病患者数据,这名患者在接受治疗后第90天时,恢复了自身胰岛素的产生,并将每天胰岛素注射了减少91%。
随后,该患者随访270天的最新数据再次发布,结果显示该患者已经完全不需要依赖外源性胰岛素注射来控制血糖水平,HbA1c已下降至 5.2%,完全在代谢健康的非糖尿病成人的范围内。该结果的发布无疑是振奋人心的,表明干细胞疗法或将成为治愈1型糖尿病的潜在希望!

目前的研究证据表明干细胞是治疗糖尿病的具有前景的方法。科学家们在这一领域不断探索,包括干细胞的来源以及如何提高干细胞的治疗效力等等,在这个过程中,多种给药载体不断被研发,如水凝胶和生物支架等。相信未来随着基础研究的进一步深入以及临床研究的不断开展,干细胞有望成为糖尿病治疗的利剑!
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/27027.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫