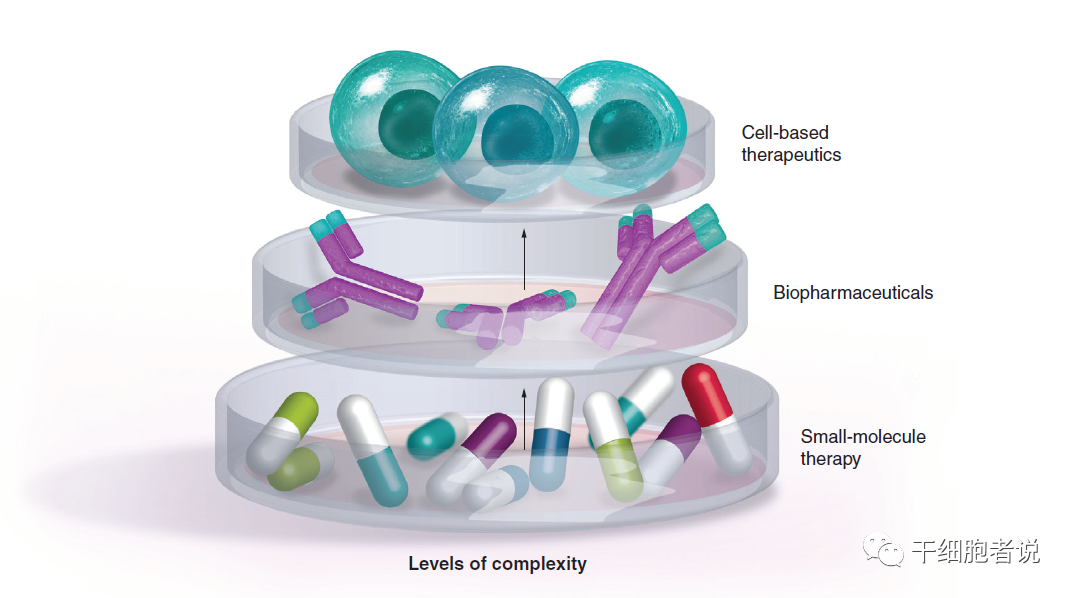
细胞药物开发的复杂水平
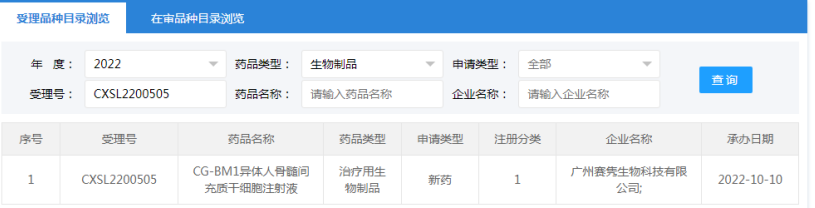
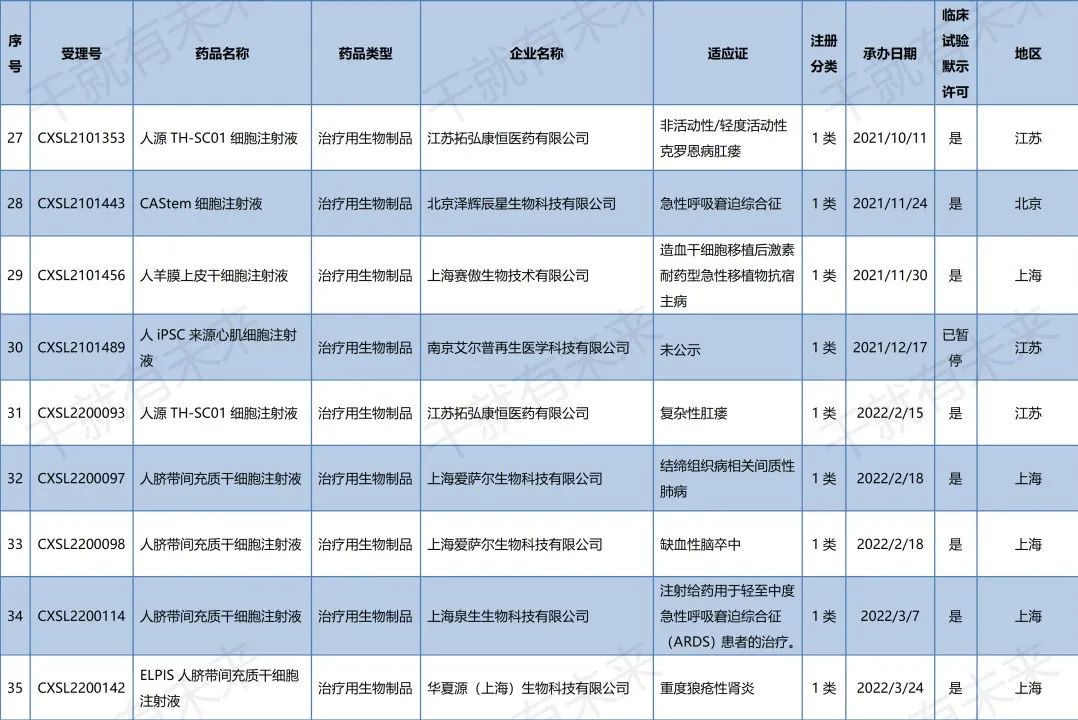
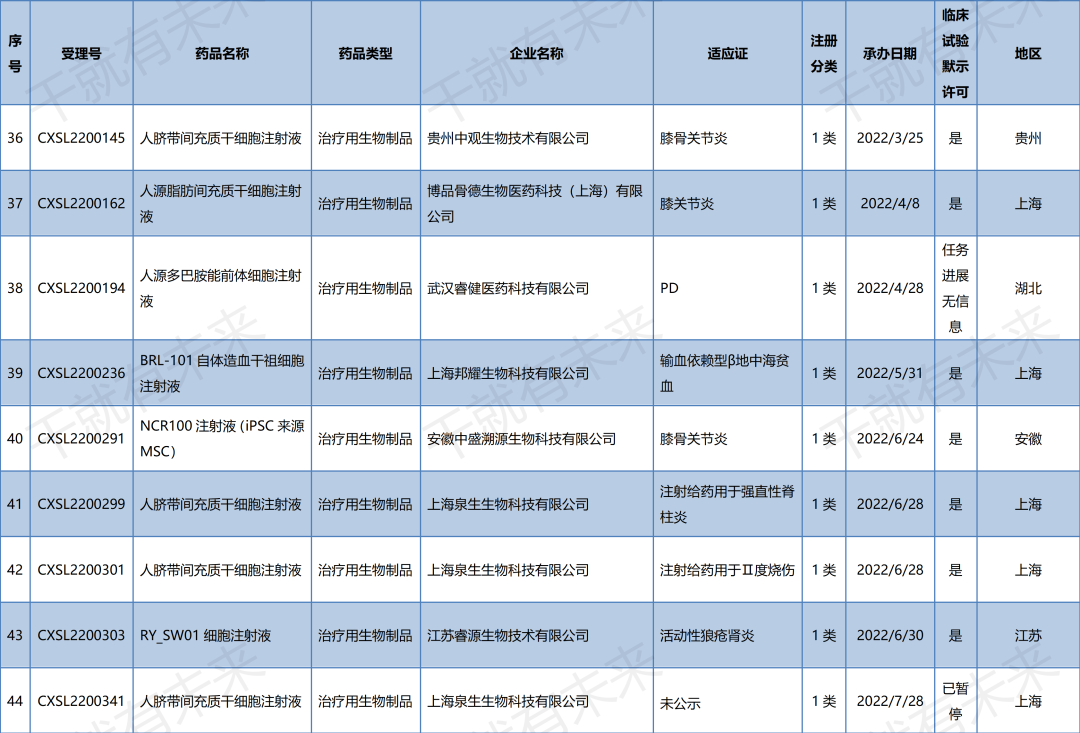
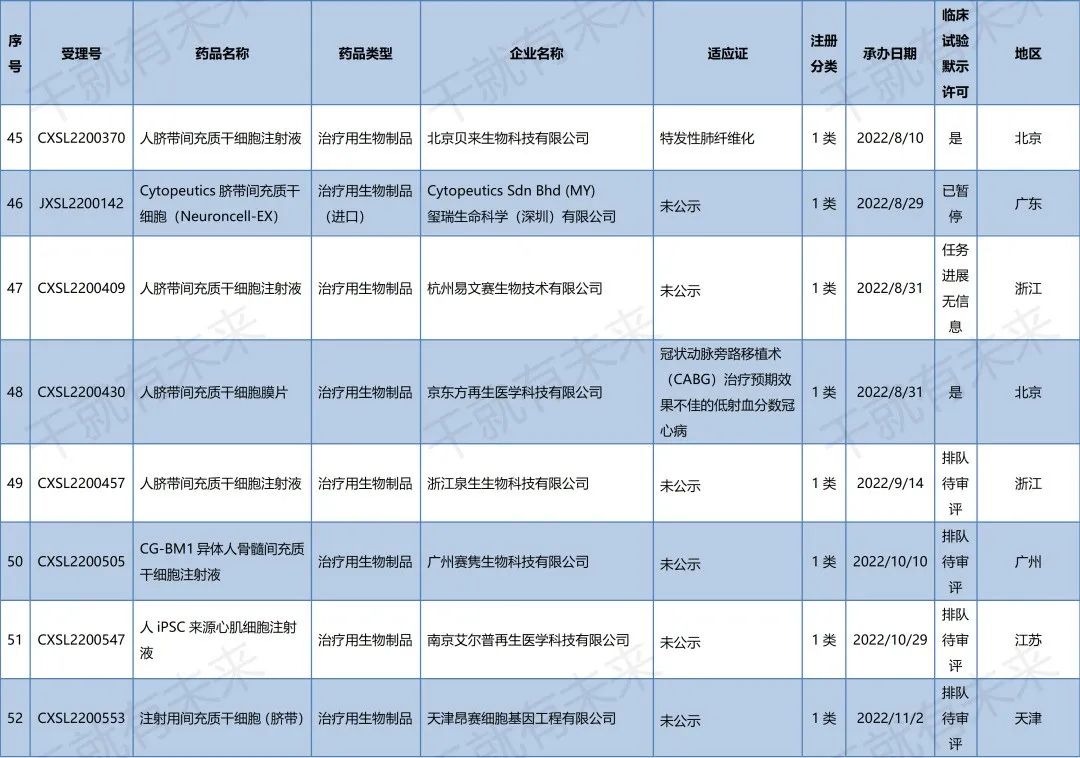
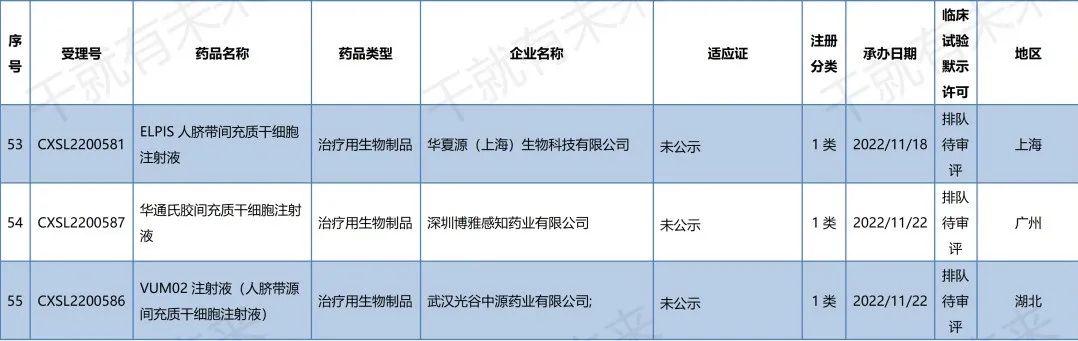
2022年10月14日,广州赛隽生物科技有限公司“CG-BM1异体人骨髓间充质干细胞注射液”的药物临床试验申请获受理(受理号:CXSL2200505)。这是自2021年9月26日起,广州赛隽生物“CG-BM1异体人骨髓间充质干细胞注射液”的第2种适应证申请获得受理。此前,该干细胞注射液已获得默示许可用于感染引起的中重度成人急性呼吸窘迫综合征(受理号:CXSL2101334)。
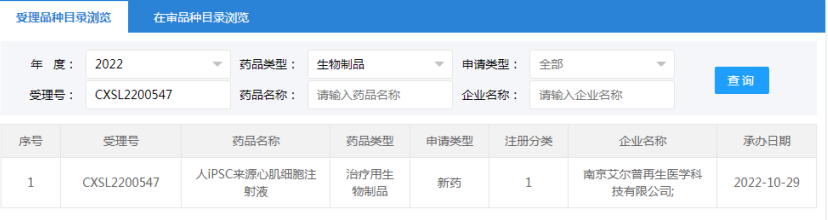
2022年10月29日,南京艾尔普再生医学科技有限公司“人iPSC来源心肌细胞注射液”的药物临床试验申请获受理(受理号:CXSL2200547)。这是继2021年12月17日南京艾尔普“人iPSC来源心肌细胞注射液”之后的第二次申报获得受理,此前该干细胞药物(受理号:CXSL2101489)申报已暂停,此次申报受理可以视为是该干细胞药物完善材料后的第二次申报。
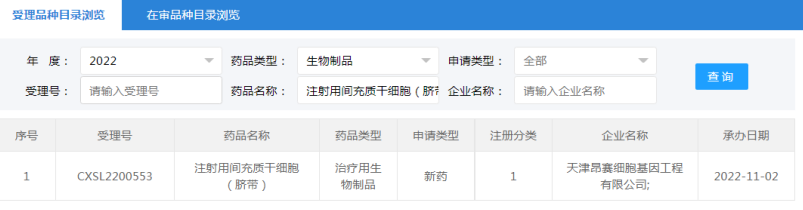
2022年11月2日,天津昂赛细胞基因工程有限公司“注射用间充质干细胞(脐带)”的药物临床试验申请获受理(受理号:CXSL2200553)。这是自2018年9月30日起,天津昂赛“注射用间充质干细胞(脐带)”的第4种适应证申请获得受理。此前,该干细胞注射液已获得默示许可用于移植物抗宿主病(受理号:CXSL1800101)、慢加急性(亚急性)肝衰竭(受理号:CXSL2000335)、急性呼吸窘迫综合征(受理号:CXSL2100056)的临床试验。
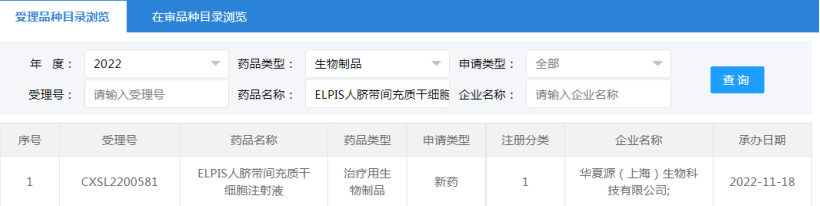
2022年11月18日,华夏源(上海)生物科技有限公司“ELPIS人脐带间充质干细胞注射液”的药物临床试验申请获受理(受理号:CXSL2200581)。这是自2021年7月30日起,华夏源“ELPIS人脐带间充质干细胞注射液”的第3种适应证申请获得受理。此前,该干细胞注射液已获得默示许可用于中/重度慢性斑块型银屑病(受理号:CXSL2101224)、重度狼疮性肾炎(受理号:CXSL2200142)的临床试验。
2022年11月22日,武汉光谷中源药业有限公司“VUM02注射液”(人脐带源间充质干细胞注射液)的药物临床试验申请获受理(受理号:CXSL2200586)。这是武汉光谷中源药业第一款受理的干细胞药物。
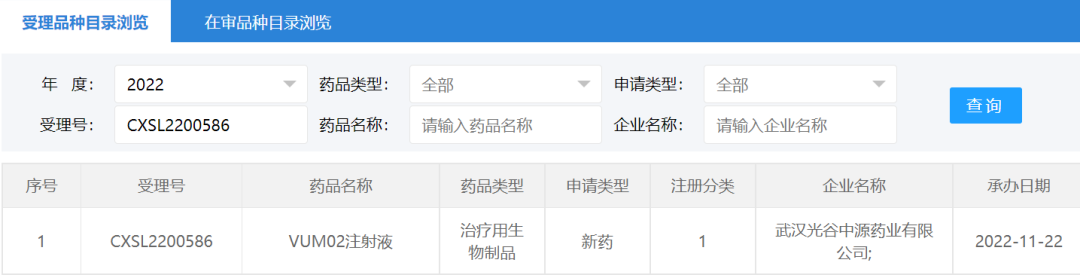
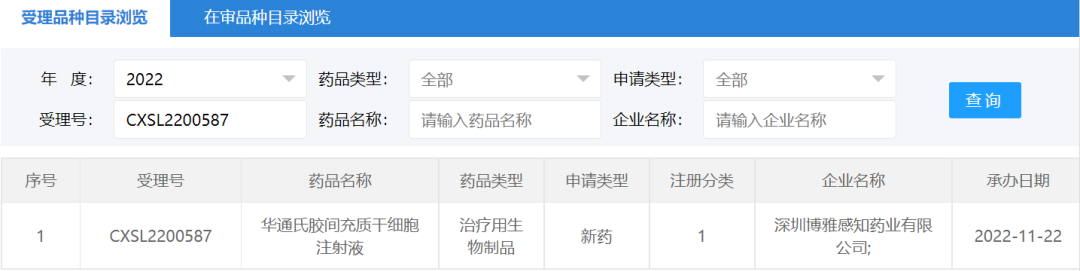
2022年11月22日,深圳博雅感知药业有限公司“华通氏胶间充质干细胞注射液”的药物临床试验申请获受理(受理号:CXSL2200587)。这是深圳博雅感知药业第一款受理的干细胞药物。
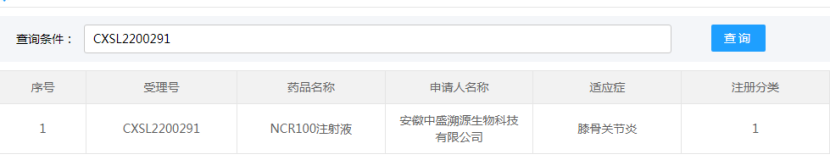
安徽中盛溯源生物科技有限公司的“NCR100注射液”(诱导多能干细胞来源的间充质干细胞)的药物临床试验申请获得默示许可(受理号:CXSL2200291),适应证为:膝骨关节炎。
上海泉生生物科技有限公司的“人脐带间充质干细胞注射液”的药物临床试验申请获得默示许可(受理号:CXSL2200299与CXSL2200301),适应证为:强直性脊柱炎和Ⅱ度烧伤。

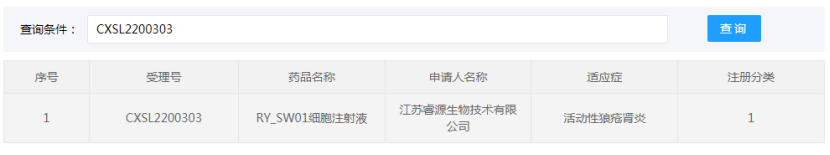
江苏睿源生物技术有限公司的“RY_SW01细胞注射液”(间充质干细胞药物)的药物临床试验申请获得默示许可(受理号:CXSL2200303),适应证为:活动性狼疮肾炎。
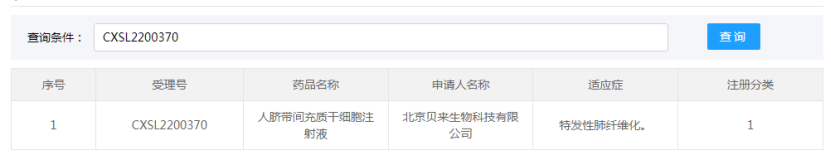
北京贝来生物科技有限公司的“人脐带间充质干细胞注射液”的药物临床试验申请获得默示许可(受理号:CXSL2200370),适应证为:特发性肺纤维化。
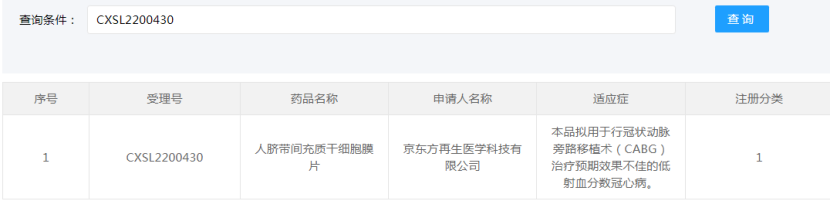
2022年11月22日,药品监督管理局药品审评中心官网显示,京东方再生医学科技有限公司自主研发的“人脐带间充质干细胞膜片”(受理号:CXSL2200430)获得新药临床试验默示许可,适应证为:用于行冠状动脉旁路移植术(CABG)治疗预期效果不佳的低射血分数冠心病。

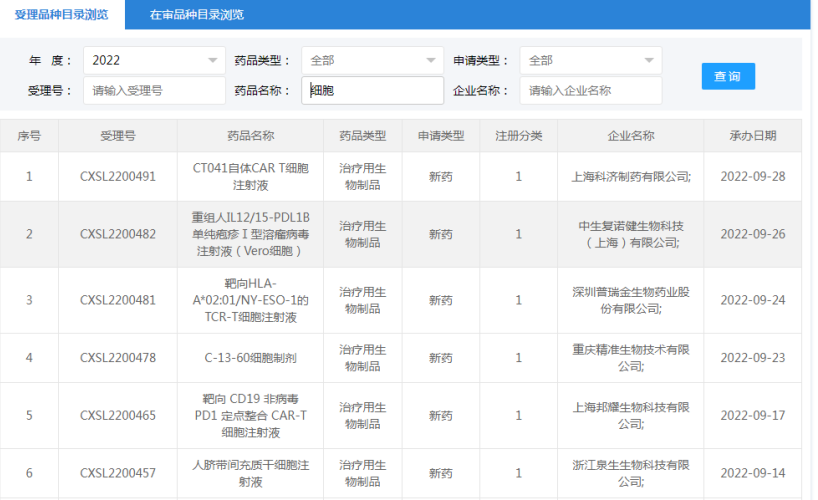
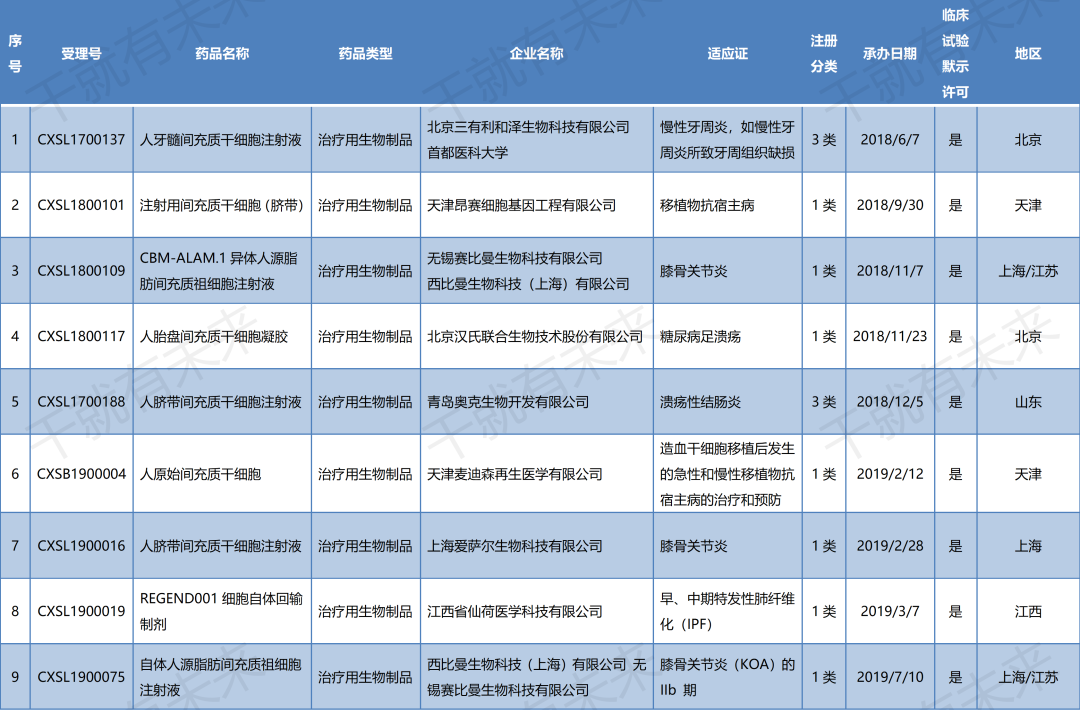
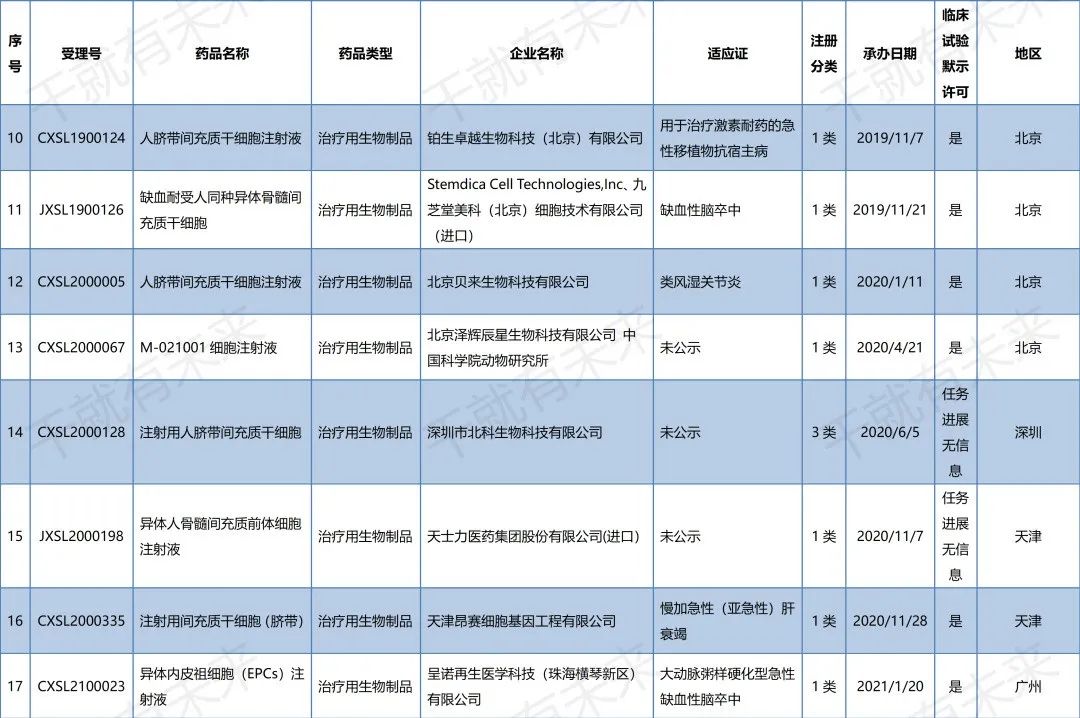
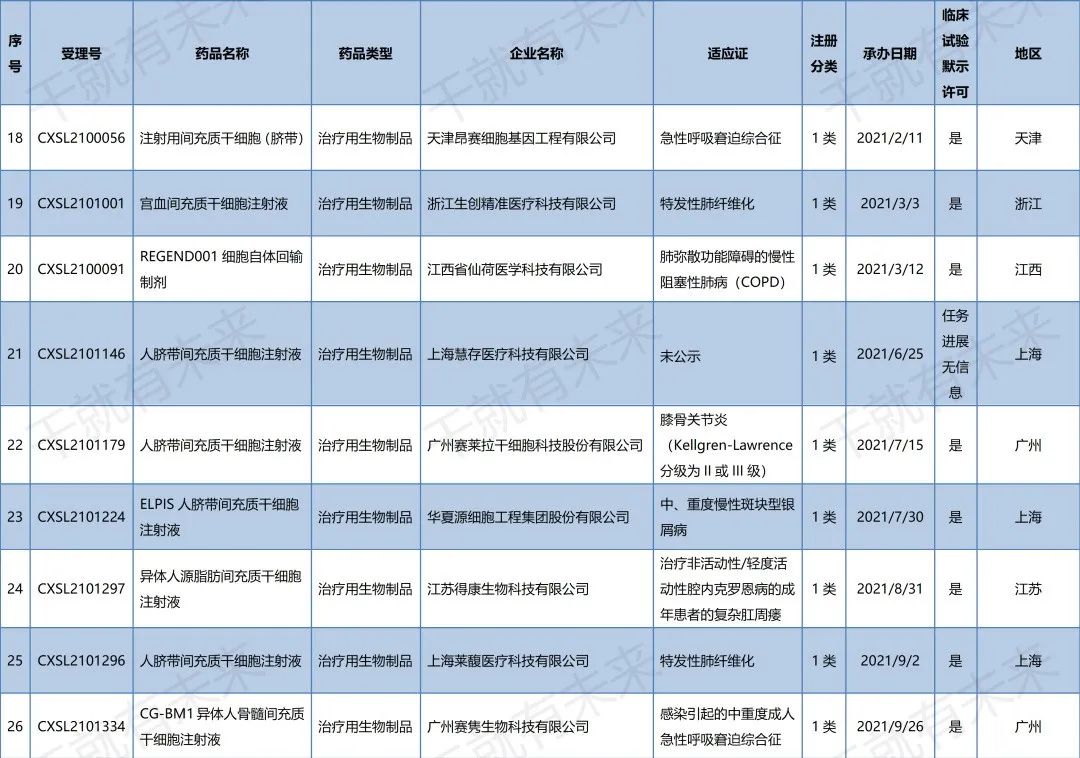
▉ 国内干细胞药物临床试验申请受理清单
(截至2022年11月30日)
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/23247.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫