编辑|南风
看点导读:
1、目前开展的干细胞研究中,多数以间充质干细胞为主;
2、不同来源的干细胞疗效存在差异;
3、以往的研究中干细胞输注的基础剂量常参考自肝病的治疗;
4、干细胞治疗肝病的机制不是分化成肝细胞,而是旁分泌作用;
5、重复输注干细胞治疗肝病的效果优于单次最佳剂量;
6、预激活和3D培养的MSCs在体外和体内都表现出更好的抗纤维化能力;
7、细胞外囊泡和外泌体是无细胞治疗肝病的方向,但目前开展的研究不足
最近发表在《Stem Cell Research & Therapy》杂志上的一篇关于干细胞治疗肝病的综述,很好的总结了目前基于干细胞疗法的肝病治疗进展,现摘取其中部分内容,编译后分享给读者。
正文:
肝病每年导致全球约200万人死亡,占每年死亡总数的3.5%,其中100万人死于肝硬化并发症[1]。肝硬化是全球第11位最常见的死亡原因,未来全球死于该病的人数和比例将继续增加(2017 年肝硬化死亡人数超过132万人,但1990年死亡人数不到899,000 [2] )。
慢性肝病一般按严重程度分为四个阶段:
(1)炎症;(2)肝纤维化;(3)肝硬化;(4) 终末期肝病 (ESLD) 或肝癌 [3]。这是一个递进的过程,其中晚期肝硬化或ESLD 的肝功能不可逆地受损;唯一的治疗方法是肝移植(OLT)。由于OLT的主要局限性,如免疫排斥反应、术后不良并发症、缺少器官供体等,所以应积极探索新的治疗策略程。
1976 年,第一个临床前原代人肝细胞(PHHs)移植,阐明了细胞疗法的前景 [4]。此后,慢性肝病的细胞疗法发展迅速。PHHs被认为是治疗代谢性肝病的理想来源,并已投入临床应用[5]。然而,PHHs 很难在体外扩增,而且它们的来源非常有限,以至于人们不得不转向其它的细胞来源。目前,干细胞在I期和II期临床试验中对治疗肝纤维化和肝硬化均被证明有效,干细胞疗法也有望逆转肝纤维化和肝硬化。
由于人类原代干细胞提取和应用的伦理问题,使用干细胞治疗肝纤维化和肝硬化的临床试验数量有限。在过去的几十年中,干细胞疗法在动物模型中的有效性、可行性和安全性已在文献中得到广泛报道[6,7]。但是由于临床标本获取困难,目前人类肝病的干细胞疗法只能获得患者的结果。
干细胞治疗的作用机制先前已总结为两个主要途径:
(1)体外诱导直接分化成功能细胞以替代受损细胞;
(2)体内旁分泌生物活性因子和调节炎症进展的免疫调节因子。
在纤维化疾病中,据报道,干细胞分泌的细胞外基质 (ECM) 重塑介质如基质金属蛋白酶 (MMP) 和金属蛋白酶组织抑制剂 (TIMP) 有助于纤维化逆转。与传统治疗方案相比,基于干细胞的疗法对患者的侵入性低于手术,并且免疫排斥的风险较低。在本文中,总结了使用干细胞治疗肝纤维化和肝硬化领域的最新临床进展,希望能为随后的干细胞临床转化提供见解。
o1 利用干细胞治疗肝硬化/纤维化的临床进展
当在clinicaltrials.gov上搜索“肝病”和“干细胞”等其关键词时,共有160个使用干细胞治疗肝病的临床试验,包括终末期肝病、肝癌、肝纤维化和肝硬化,其中75 项试验(47%)侧重于肝硬化或肝纤维化(不包括已终止和撤回的试验)。在这75个案例中,大多数试验集中在 I/II 期(36%)(图 1A)。
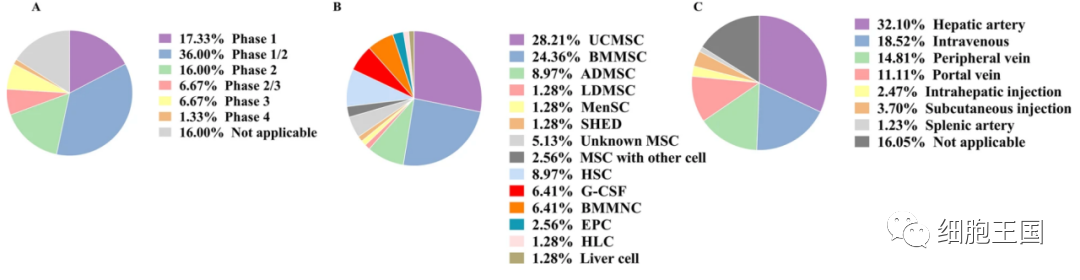
注册的干细胞治疗肝纤维化或肝硬化的相关临床试验的分类。A按临床阶段分类的临床试验;B目前临床试验中应用的不同干细胞;UCMSC,脐带间充质干细胞;BMMSC,骨髓间充质干细胞;ADMSC,脂肪来源的间充质干细胞;LDMSC,肝源性间充质干细胞;MenSC,经血来源的间充质干细胞;SHED,来自人类脱落的乳牙的干细胞;HSC,造血干细胞;G-CSF,粒细胞集落刺激因子;BMMNC,骨髓单个核细胞;EPC,内皮祖细胞;HLC,肝细胞样细胞;C按递送途径分类的临床试验。
对于细胞疗法,以下是特别值得关注的:细胞类型、细胞数量和给药途径。
用于治疗肝纤维化或肝硬化的细胞来源多种多样,最广泛使用的是间充质干细胞 (MSCs) (73%) (图1B )。目前应用于临床试验的间充质干细胞来自不同组织,如骨髓、脐带、脂肪、经血、牙髓和肝脏。此外,荟萃分析表明,源自骨髓的干细胞比源自脐带的干细胞更有效,并且在终末期肝病(MELD)评分、白蛋白(ALB)水平、丙氨酸氨基转移酶(ALT) 水平和总胆红素 (TBil) 等指标,骨髓间充质干细胞 (BMMSC) 组略优于脐带间充质干细胞 (UCMSC) 组[8]。这可能是由于从不同组织中分离出来的 MSCs 的粘附和迁移或归巢特性的差异。注入循环系统的细胞的命运以及细胞在损伤部位促进修复和免疫调节的能力受这两种特性的影响。USMSC 似乎比 BMMSC 更迅速地从流动中粘附和迁移,但 BMMSC 在扩散动力学方面超过了USMSC [9]。更重要的是,目前无法分辨谁更适合肝脏,UCMSC 还是BMMSC?其他可能的解释包括 BMMSC 清除细菌和细胞存活率,以及与UCMSC [10]相比对促/抗炎反应的调节能力。
在之前的一项研究中,MSC的移植提高了造血干细胞 (HSC) 的移植成功率 [11]。加瓦姆扎德等人[12] 证明HSC与MSC的共同移植提高了供体来源的细胞对受体肝细胞的替代率,并减轻了肝纤维化。此外,静脉内MSCs的寿命短,大量滞留在肺脏[14]。鉴于此,MSC 需要重复多次移植以达到更好的治疗效果。
治疗需要1×106或更多的细胞计数。细胞剂量取决于患者体重、临床情况、给药途径和细胞类型。在肝硬化或肝衰竭中,肝细胞移植旨在为受损肝脏提供功能性改善的实质支持,从而修复肝脏。基于这一概念,普遍的细胞移植的计数依据约为理论肝脏质量的10-15%,高于肝脏代谢紊乱[15]。注射的最大细胞量不超过肝实质的5%(约1×1011个肝细胞)。细胞输注的并发症,如门静脉高压症和细胞栓塞,限制了可以输注的细胞数量 [16]。肝细胞移植不仅效率低下,而且需要抑制患者的免疫系统。局部给药MSCs可改善部分肝切除术后的肝纤维化 [17]。在肝纤维化和肝硬化的管理中,我们发现 MSCs 的剂量普遍低于肝细胞,这反映了MSCs的主要作用机制不是通过替代疗法,而是促进内源性生物活性分子介导的再生和免疫调节。在安全和最低有效给药剂量范围内,低、中、高剂量组的结果似乎没有差异 [18]。间隔和重复多次注射(例如每周两次)的治疗效果似乎更稳定和显着。
细胞治疗途径目前分为两类:干细胞悬液输注或干细胞生物工程改造产物移植。通过肝动脉给药(32%)是大多数临床试验的首选(图1 C)。这可能是因为通过肝动脉输注的干细胞比静脉输注具有更好的细胞定植能力 [20]。值得注意的是,在这些临床试验中,只有一项使用了生物工程产品,即与 hUCMSCs 结合的可注射胶原支架 (NCT02786017)。
除了临床试验的细节,细胞疗法的安全性和有效性是最重要的。干细胞在治疗肝硬化或肝纤维化的临床试验中取得了惊人的进展。可用于评估干细胞效率的常用指标是血清ALB 水平、血清胆红素、Child-Pugh评分和MELD 评分。安全性评估主要根据术后不良并发症,如发热、过敏反应、咳嗽、胸闷和呼吸困难等。虽然这些临床试验看起来更安全,但仍需要更大规模的研究。使用干细胞治疗肝纤维化或肝硬化的代表性临床试验(见表1)。
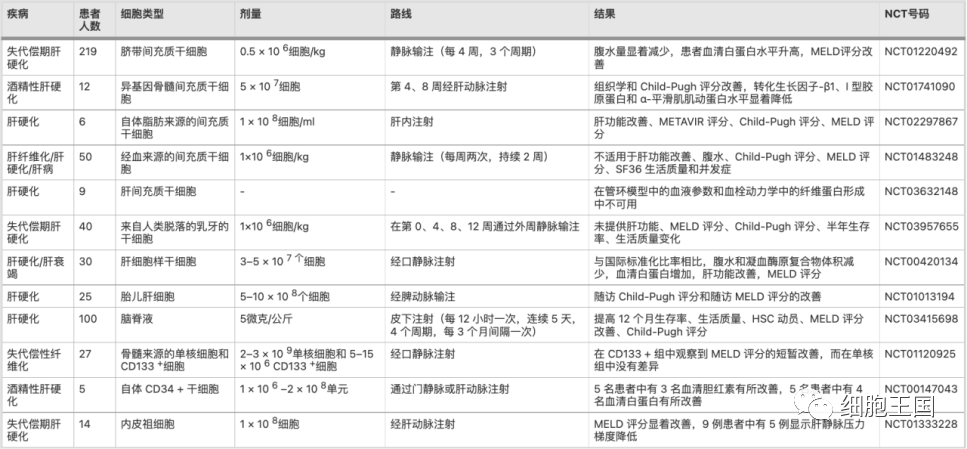
表 1 使用干细胞治疗肝纤维化或肝硬化的代表性临床试验
o2 用于肝纤维化/肝硬化治疗的干细胞类型
从上述临床试验中,我们了解到有多种细胞类型可用于肝纤维化和肝硬化的管理,以下是所提到的细胞类型的详细描述(图2)。
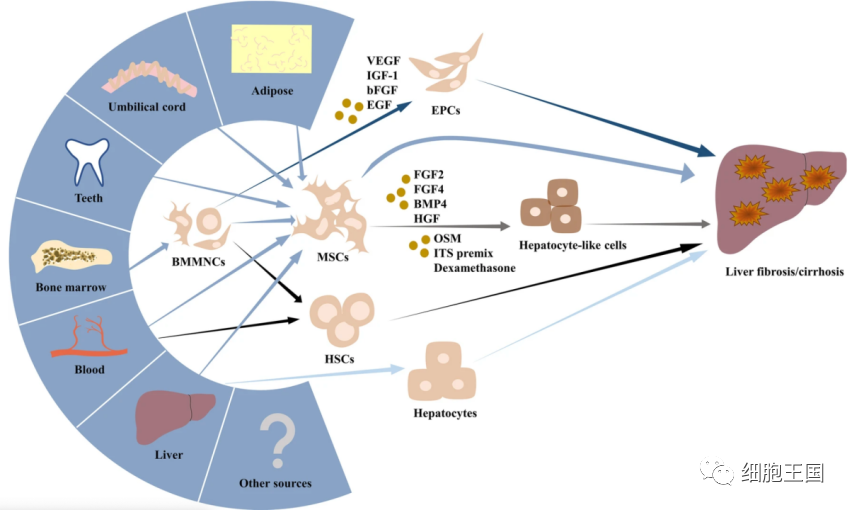
用于治疗肝纤维化/肝硬化的候选干细胞类型。用于治疗肝纤维化/肝硬化的不同类型的干细胞,尤其是间充质干细胞,可以来源于脂肪、脐带、牙齿、骨髓、血液、肝脏等多种组织。体外分化的肝细胞样细胞和EPCs可以也可用作替代细胞来源。
间充质干细胞
间充质干细胞是应用最广泛的干细胞类型,可以从每个成人或围产期组织中获得,包括普通骨髓、脐带、脂肪组织、肝脏、牙齿和经血。近年来,MSCs也可从尿液[21]和胎盘的不同部位[22] 中提取。MSC具有相同的特征(CD73、CD90和CD105阳性,CD34、CD14或 CD11b、CD79 或 CD19、HLA-DR 阴性)[23]。
脐带间充质干细胞
UCMSCs可以从沃顿的果冻和脐带血中获得。获得收获细胞的一般方法有两种:酶消化法和外植体法。UCMSCs 应按照批准的良好生产规范 (GMP) [24] 制备。
hUCMSCs 通过分泌肝细胞生长因子 (HGF) 和增加硫代乙酰胺损伤小鼠肝脏中增殖细胞核抗原 (PCNA) 和 Est-1 p42 蛋白的表达来促进肝脏修复和改善再生生态位 [25]。此外,hUCMSCs 在肝病小鼠模型中也表现出优异的免疫抑制能力和高Treg促进作用 [26]。hUCMSCs移植通过上调microRNA-455-3p介导p21活化激酶 2 (PAK2) 沉默来抑制肝星状细胞的活化[27]。
骨髓间充质干细胞
BMMSCs 是从骨髓单个核细胞 (BMMNCs) 中分离出来的。将BMMNCs接种在培养瓶中,然后去除非贴壁细胞,从而形成定植的BMMSCs [28]。
由于抗凋亡白细胞介素 (IL)-6、胰岛素样生长因子结合蛋白-2 (IGFBP-2) 和抗炎性IL-1受体拮抗剂 (IL-1Ra),植入受损组织的微囊化BMMSCs具有保护作用细胞因子被释放[29]。此外,肝脏特异性ECM诱导BMMSCs转分化为肝谱系,并通过替代肝实质细胞来逆转肝纤维化[30]。
脂肪来源的间充质干细胞
脂肪来源的间充质干细胞 (ADMSCs) 可以从吸脂物或皮下脂肪碎片中获得并在体外扩增。用胶原酶消化脂肪组织,收集所得分散细胞并在培养瓶培养[31]。
ADMSCs 治疗脂肪性肝炎诱导的肝硬化后,炎症浸润的 CD11b +细胞、Gr-1 +细胞的数量和 CD8 + /CD4 +的比例降低 [32]。目前,ADMSCs和BMMSCs被认为通过类似的机制缓解纤维化 [33]。
肝源性间充质干细胞
简而言之,从肝脏碎片中分离出单个核细胞并在体外培养以获得肝源性间充质干细胞(LDMSCs)。实验室已成功分离出人肝源性间充质样干细胞,这些干细胞高度表达GATA4 和FOXA1等内胚层标志物。LDMSCs对CD29、CD73、CD44、CD90、CD105 和 CD166 以及白蛋白、甲胎蛋白、细胞角蛋白8 和细胞角蛋白18这些肝脏标志物呈阳性[34]。LDMSCs 既表达了MSC的一些表面标志物,又具有肝细胞的一些功能,因此表明部分致力于肝分化 [35]。
在硫代乙酰胺诱导的肝损伤免疫缺陷 NRG 小鼠模型中,与hUCMSCs相比,hLDMSCs在受损肝脏中移植的速度更快,分化成成熟的肝细胞 [36]。此外,与BMMSCs相比,LDMSCs分泌更高水平的促血管生成、抗炎和抗凋亡细胞因子 [34]。
经血来源的间充质干细胞
经血来源的间充质干细胞 (MenSCs) 是通过密度梯度离心法从离心的人经血中分离出来的,它们表达MSC标志物,但不表达 HLA-DR、CD34、CD45、CD117。有趣的是,其他来源的MSCs中不存在阶段特异性胚胎抗原 4 (SSEA4),但MenSCs中SSEA4的表达存在争议[37,38]。
MenSCs显着降低肝组织中 α-平滑肌肌动蛋白 (α-SMA) 和转化生长因子-β1 (TGF-β1) 的表达,并通过旁分泌介质如单核细胞趋化蛋白-1 (MCP-1) 抑制活化的肝星状细胞、IL-6、HGF等,进一步降低了四氯化碳诱导的肝纤维化中的胶原蛋白含量[39]。
来自人类脱落的乳牙的干细胞
来自人类脱落的乳牙 (SHED) 的干细胞是从健康的儿科捐赠者脱落的乳牙的残余牙髓组织中分离出来的。不同隔离方法获得的 SHED 的性能存在差异 [40]。它们具有MSC特征,包括细胞表面抗原表达和三系分化潜能。
移植的SHED能够在体内产生肝细胞样细胞,在肿瘤坏死因子-α(TNF-α)的刺激下,SHED-Heps显示出胆管生成潜力[41]。此外,SHED下调受损肝脏中与ECM分辨率相关的介质,如MMP-2、MMP-9、TIMP-1 和 TIMP-2 [42]。SHED 通过防止炎症浸润促进肝纤维化的恢复 [43]。
造血干细胞
HSC是在骨髓和血液中发现的原始细胞。HSC 是从接受粒细胞集落刺激因子 (G-CSF) 皮下注射或通过流式分选系统从骨髓分选的患者中提取的外周血单个核细胞中纯化的。此外,HS也可以从脐带血中获得。因此,HSC对CD34、CD45 和 CD133 呈阳性 [44]。
有两种方法可用于将干细胞从骨髓转移到肝脏。一种是从骨髓中分离干细胞,然后将其注入体内,另一种是使用G-CSF等细胞因子。任何能够动员骨髓干细胞 (BMSCs) 的药物都可用于治疗肝纤维化,但改善程度可能与动员效率不成正比 [45]。G-CSF动员BMSCs到达受损的肝脏进行修复 [46]。然而,最近的随机临床试验表明,无论是否与HSC联合,G-CSF 都不能改善代偿期肝硬化患者的MELD评分,这可能是由于G-CSF的不良反应 [44]。与 BMMSC相比,HSC在肝损伤中的抗炎和抗氧化作用可以忽略不计 [47]。HSC对肝脏修复的贡献主要是通过释放刺激内源性肝细胞再生和促进肝内血管生成的旁分泌因子[48]。HSC 移植或HSC与其他干细胞共同移植已被证明在难治性腹水伴肝纤维化 [49] 或蛋白缺乏症患者[50] 中是可行的。
骨髓单个核细胞
BMMNCs 是从骨髓中分离出来的,该骨髓是在局部麻醉下通过密度梯度离心从患者的髂后嵴抽吸出来的。BMMNCs 是由多个干细胞/祖细胞组成的细胞群。BMMNCs 的表征包括三种类型:内皮谱系标志物,如CD31和血管内皮生长因子受体 (VEGFR)、BMMSC表面标志物和HSC 标志物 [51]。
骨髓来源的 CD11b + CD14 +单核细胞通过减少氧化应激和炎症来改善肝纤维化,单核细胞治疗的小鼠具有更高水平的谷胱甘肽 (GSH),这代表了抗氧化能力。此外,单核细胞治疗组表现出促炎性 TNF-α 和 IL-6 下调和抗炎性 IL-10 上调 [52]。除此之外,BMMNCs 的丙二醛和标准化总抗氧化能力 (TAC)、谷胱甘肽过氧化物酶 (GPx)、过氧化氢酶 (CAT) 和超氧化物歧化酶 (SOD) 均显着下降 [53]。
内皮祖细胞
内皮祖细胞 (EPC) 从各种组织中获得,在临床实践中最常被称为 BMMNC。在由细胞因子血管内皮生长因子 (VEGF)、胰岛素样因子-1 (IGF-1)、碱性成纤维细胞生长因子 (bFGF) 和表皮生长因子 (EGF) 组成的内皮完全培养基下诱导 BMMNCs。以这种方式获得的 EPC 对 VEGFR-1、von Willebrand 因子 (vWF) 和 Ulex 结合呈阳性 [54]。
EPCs移植通过在四氯化碳诱导的肝纤维化中分泌更高的MMP-2 和 VEGF 来激活 HGF 介导的肝细胞增殖并增加肝窦血管密度 [55]。出乎意料的是,一项研究的结果表明,在纤维化的肝脏中,注入EPC的百分比和胶原比例区域显着增加,这可能是由于EPC激活的肝星状细胞引起的VEGF和TGF-β水平较高[56] 。
肝细胞
肝干细胞的定义仍然存在争议,因为在某些情况下,肝细胞和胆管上皮细胞可以被视为各自的特定干细胞[57]。目前用于临床试验的肝细胞是成人或胎儿肝细胞。通过胶原酶灌注技术收集肝细胞[58]。新鲜肝细胞的存活率应超过60%,并且由于肝细胞的特殊特性,分离的肝细胞应立即移植或冷冻保存 [16]。
在肝硬化或肝衰竭中,肝细胞移植旨在为受损肿块提供功能性实质支持,为肝脏的恢复提供桥梁 [15]。事实上,肝细胞移植不仅效率低下,而且还需要抑制患者的免疫系统。目前,肝细胞移植没有标准的免疫抑制方案。大多数中心采用与OLT相同的方案,例如他克莫司和单克隆抗体的组合 [16]。引人注目的是,肝祖细胞(LPCs)是一类可以进一步分化为肝细胞和胆管上皮细胞的双能干细胞。它们被认为在长期肝损伤中起关键作用 [60]。LPCs被认为是内源性肝再生的重要链。最近的研究表明,肝细胞和胆管上皮细胞之间可以相互转分化以促进肝脏修复,而不会经历慢性肝损伤过程中肝祖细胞的状态[61,62]。
肝细胞样细胞
各种干细胞已显示出体内肝分化的潜力,因此肝细胞样细胞 (HLC) 也已在临床上用于治疗肝纤维化或肝硬化疾病。然而,MSC,中胚层衍生的细胞,一直在等待它们沿着内胚层分化成成熟肝细胞的能力。
研究人员分别比较了MSCs治疗组和HLCs治疗组的疗效;两组的肝功能均有所改善,但 MSCs在某些参数上表现出更好的结果 [69,70]。这可能导致MSC衍生的HLC通常受到限制,并且在功能上与原代肝细胞不同 [71]。在一项研究中,建议分化的诱导多能干细胞 (iPSCs) 比未分化的iPSCs能更有效地进行移植。用每公斤体重4.0×107个iPSCs 衍生的肝细胞治疗显着减轻了小鼠的严重肝功能衰竭;然而,等效剂量的iPSC没有显着的治疗效果[72]。这表明胚胎干细胞(ESCs)或iPSCs需要先分化才能产生理想的治疗效果。
o3 各种干细胞的潜在优势和局限性
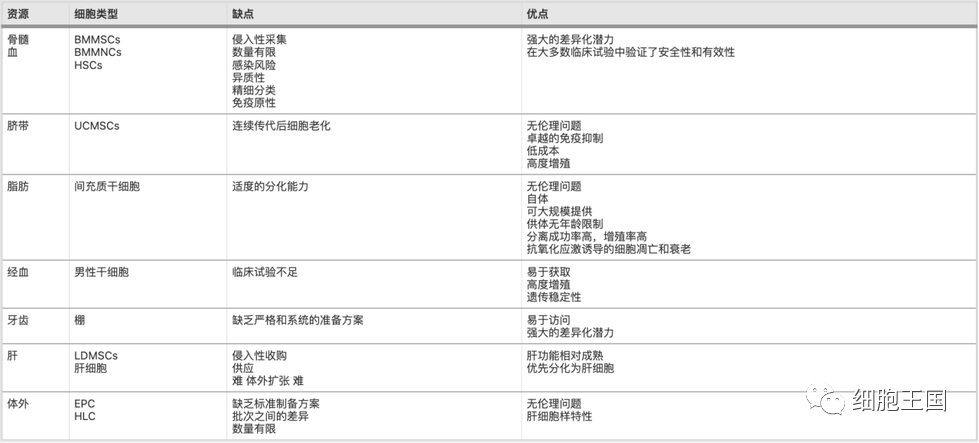
干细胞来源的优缺点比较
尽管目前临床使用的UCMSCs是同种异体的,但围产期MSCs高表达HLA-G,这对于妊娠期间母体免疫系统的适应以及对所有免疫细胞的抑制作用至关重要,使UCMSCs具有先天免疫豁免特权 [73] 。UCMSCs在P3代时表现出最强的增殖能力,然后随着体外传代次数的增加而缓慢减弱 [74]。UCMSCs 特征性地表达与包括NPY在内的神经元发育相关的转录组,意味着UCMSCs更优先分化为神经细胞,并在神经系统疾病中具有应用前景[75]。
制备成本低、体外大规模扩增的便利性以及不存在伦理问题,使UCMSCs成为临床使用的最有希望的细胞来源。
与UCMSCs相比,BMMSCs具有优越的中胚层分化能力,包括成骨或软骨和脂肪的形成。一组与抗菌活性相关的基因在BMMSCs中表达较多,而与基质重塑相关的基因在UCMSCs中表达较多 [76]。BMMSCs具有很强的分化潜能,但人BMMSCs是通过侵入方式获得的,数量有限,阻碍了BMMSCs在临床应用中的进一步发展。
由于ADMSCs对高氧诱导的细胞凋亡和氧化应激诱导的衰老具有更强的抵抗力,此外,其优越的促血管生成能力和高端粒酶活性,使ADMSCs在再生能力方面比BMMSCs具有独特的优势 [77]。ADMSCs和BMMSCs在免疫表型上没有显着差异。ADMSCs 的另一个最明显的优点是它们更高的分离成功率和增殖率 [78]。ADMSCs 采集简单,可广泛获得,细胞活力不受供体年龄的限制,因此在再生医学中具有广泛的应用范围。
LDMSCs更接近肝脏本身的环境,特别是当它们表达内胚层相关标志物时,但正常胎儿肝脏的来源有限。LDMSCs目前在临床试验中并不普遍。
与BMMSCs相比,没有诱导刺激的MenSCs能够在没有染色体异常的情况下扩增18代 [37]。与BMMSCs相比,MenSCs的增殖能力高2-4倍,其中30-47个种群在衰老前翻了一番 [79]。然而,令人担忧的是,很少有临床试验使用MenSCs治疗肝病,标准提取方案和培养条件是关键问题。安全性和有效性尚未得到充分验证。
SHED在神经源性方面比BMMSCs更有效[80]。
HSC移植首先应用于血液病领域。考虑到临床应用[81] ,保持HSC的自我更新和未分化状态以进行离体扩增是目前的一项严峻挑战。符合临床管理标准的HSC短缺和低免疫原性 HLA匹配的HSC来源有限[82]。鉴于制备自体HSC的复杂性和高成本以及细胞数量的限制,HSC更适合血液病患者群体。
由于BMMNCs中包含的细胞类型丰富,BMMNCs具有异质性。BMMNC 越来越多地用于临床试验,没有进一步细分。BMMSCs 移植改善了肢体缺血和增加血流量,但 BMMNCs 没有显着效果 [83]。由BMMNC的成分复杂,其临床应用仍存在歧义。
EPCs在临床治疗中的关键限制是数量少[84]。EPCs需要人工诱导体外生长,EPCs的异质性和工艺标准阻碍了其在临床上的发展。
肝实质细胞是治疗肝病最理想的细胞来源,但PHHs衍生疗法在临床应用中遇到了诸多挑战,如PHHs在传统培养条件下增殖能力有限、失去原有表型等和体外功能,以及较难获取[71]。
体外HLC的诱导需要数周的细胞因子冲洗。此外,分化的HLCs的异质性和HLCs的肝功能密切依赖于细胞来源、诱导方案和细胞因子的批次。目前,标准化的制造工艺和可用于临床的细胞数量是需要解决的问题。
o4
干细胞治疗肝纤维化的机制
肝纤维化的发展是损伤修复的过程随之带来的组织异生,涉及肝细胞死亡、免疫细胞浸润、肝损伤、肌成纤维细胞活化和细胞外基质过度沉积等关键事件。我们将深入了解干细胞如何调节的这五个方面(图3)。
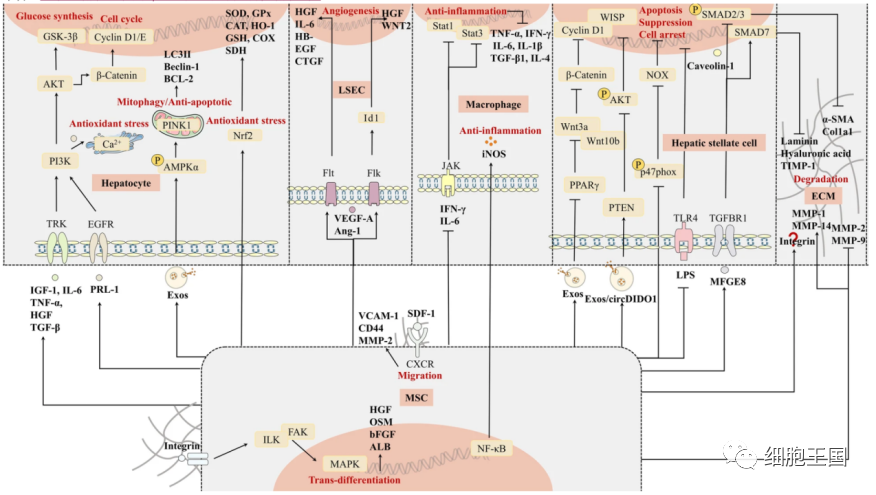
干细胞治疗肝纤维化的机制。干细胞,主要是间充质干细胞,通过迁移和转分化替代肝细胞功能,分泌多种细胞因子促进肝细胞增殖,增强肝细胞抗凋亡和抗氧化能力,促进LESC增殖,抑制肝巨噬细胞炎症因子的分泌, 抑制肝星状细胞的活化, 促进活化细胞的凋亡, 关键是降解ECM, 延缓肝纤维化的进程。
肝再生
干细胞促进肝再生的机制可细分为三个方面:干细胞迁移入肝并转分化为肝细胞,分泌血管生成相关细胞因子促进新生血管协同促进肝再生,激活宿主体内增殖信号通路内源性肝细胞。
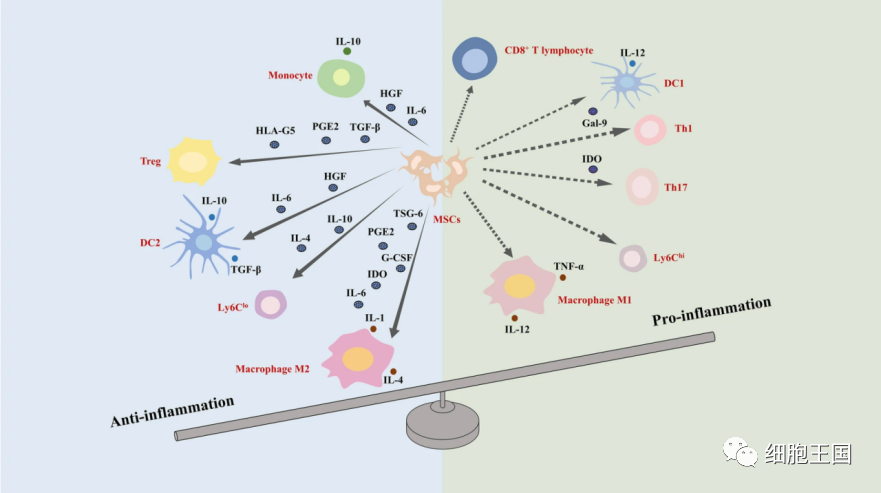
MSC介导的肝纤维化免疫调节
抗肝损伤
肝纤维化长期受到慢性损伤,多种分子如促炎因子、氧化应激产物、凋亡介质和其他细胞因子可影响其进展。MSC移植具有抗炎、抗氧化和抗凋亡的功效。
抑制肌成纤维细胞活性
肝脏中肌成纤维细胞的出现与纤维化密切相关。肌成纤维细胞具有促纤维化和促炎表型,并且高度表达α-SMA和TIMP-1 [113]。阻断肌成纤维细胞是治疗纤维化的关键靶点。
细胞外基质降解和重塑
肝纤维化与ECM过度沉积和ECM溶解活性降低有关。ECM降解和重塑被认为是逆转肝纤维化和限制肝纤维化进展为肝硬化的关键步骤。在减少沉积的ECM的同时,MSC还可以介导ECM的重排以改善纤维化。
细胞外囊泡的作用机制
细胞外囊泡 (EV) 具有与干细胞的治疗相似的营养和旁分泌作用,但作用机制和半衰期不同。
o5
结论和未来展望
从临床进展、临床阶段和干细胞给药的角度总结了目前可用于肝硬化和肝纤维化临床试验的干细胞来源。理所当然地讨论了各类干细胞在临床应用中的局限性和前景。我们从肝再生、免疫调节、抗肝损伤、抑制肌成纤维细胞活性、细胞外基质降解和重塑五个方面对干细胞改善肝纤维化进行了深入探索,证明了干细胞在体内的作用。
在干细胞治疗肝纤维化的机制中,我们注意到干细胞的旁分泌机制是干细胞发挥作用的关键,这催生了无细胞疗法的概念。但目前还没有一项临床试验涉及使用干细胞衍生的 EV 治疗肝纤维化和肝硬化。这主要是由于提取大量 EV 或外泌体的标准化方法尚未建立,并且EV 的剂量和半衰期仍不清楚。
与无细胞疗法相比,基于细胞的预处理是未来研究的热门话题。原代干细胞或未经预处理的细胞由于归巢能力差、移植后存活率极低以及体外培养过程中细胞衰老或活力下降等原因,往往无法达到预期的治疗效果。增强策略,包括刺激干细胞活化的生理微环境和病理微环境,已引起广泛关注[143]。与2D培养的MSCs相比,3D球体培养的MSCs在体外和体内都表现出更好的抗纤维化能力 [144]。
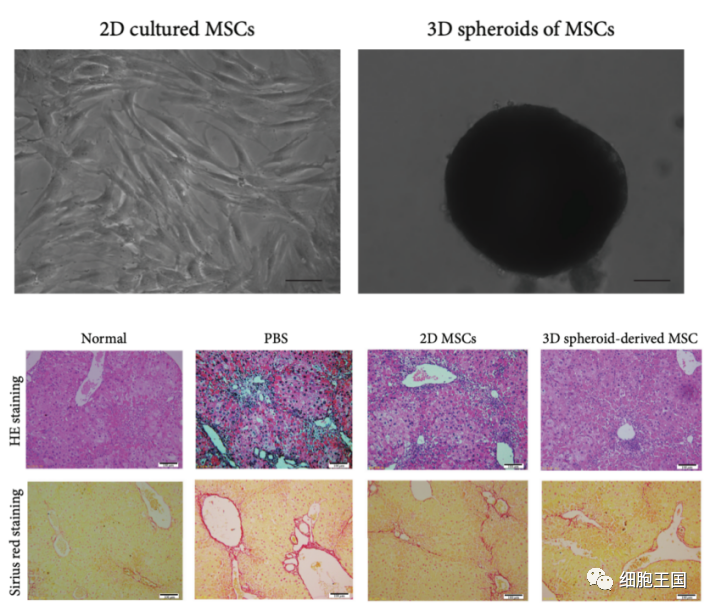
病理预处理包括缺氧、炎症因子、生物活性化合物和疾病相关细胞或患者血清。MSC的IFN-γ预处理和3D培养显示生长和免疫调节因子的产生增加。
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/15542.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫