编辑|南风
前言/ “目前,由于治疗窗狭窄、并发症严重,大多数患者不能选择静脉溶栓或血管内机械取栓。干细胞移植是一种新兴的治疗方法,并已在各种中枢神经系统疾病中进行了研究。动物和临床研究表明,间充质干细胞(MSCs)移植可以缓解神经功能缺损,为缺血性卒中治疗带来希望。
本文综述了间充质干细胞治疗的生物学特性、安全性、可行性和有效性、间充质干细胞的潜在治疗靶点以及良好生产规范级间充质干细胞的生产工艺。”
目前,溶栓和机械取栓已经彻底改变了缺血性卒中的治疗。然而,仍存在时间窗窄、出血风险、可用性和治疗成功率等问题 [1,2]。因此,寻找治疗时间窗更宽、出血风险更低的新替代方案对改善神经功能和降低死亡率非常重要。基于干细胞的疗法正在成为中风患者功能恢复的理想候选者 [3,4]。
各种类型的干细胞,如胚胎干细胞、诱导多能干细胞、神经干细胞和间充质干细胞(MSCs),以及血管和内皮祖细胞,已被用于治疗缺血性脑卒中[5]。越来越多的证据表明,间充质干细胞通可影响缺血性卒中的病理过程,包括在急性、亚急性和慢性期减少炎症、调节免疫功能、抑制细胞凋亡、促进神经血管、白质和突触重塑 [4,5]。因此,间充质干细胞可能是理想的“种子细胞”,特别适用于神经系统损伤和退行性疾病的细胞移植治疗。
在此,我们回顾了间充质干细胞移植治疗缺血性脑卒中的潜在机制和治疗靶点,包括旁分泌效应分子、调节免疫功能和神经元、白质和突触的重塑,以及GMPs级间充质干细胞的产生过程,期待有效的提高关于MSCs治疗缺血性卒中疗效的一般结论,特别是在临床试验中,并为缺血性卒中提供新的治疗方向。
o1
间充质干细胞(MSC)概述
MSCs于1970年由 Friedenstein及其同事首先发现,并于1991年被Caplan命名为“间充质干细胞”。随后,MSCs 在文献中有许多替代名称,包括间充质基质细胞、多能基质细胞、骨髓基质细胞、中胚层干细胞细胞,甚至药用信号细胞 [7]。间充质干细胞可以从多种组织中获取,并具有自我更新和多向分化的潜力,可以分化为成骨细胞、软骨细胞、脂肪细胞和支持造血的基质细胞 [7, 8]。在生长中的动物和临床研究表明,体内只有少数移植的MSCs发生了分化[8, 9],证实了MSCs主要通过其他途径发挥治疗作用,而不是分化为组织细胞[8]。因此,Caplan认为MSCs不是“干细胞”,而是作为治疗剂的药物信号细胞,以说明它们适应局部微环境的多功能性和灵活性 [8]。
目前,间充质干细胞已成为研究最广泛的干细胞,广泛用于治疗各种疾病的临床试验,包括血液疾病、肝肾肺终末期疾病、移植物抗宿主病、自身免疫性疾病、各种神经系统疾病,甚至感染COVID-19 的患者 [10,11]。
o2
MSC移植治疗缺血性卒中的安全性、可行性和有效性
中风动物模型研究
在大鼠缺血性卒中急性期,间充质干细胞治疗通过保护线粒体功能、抑制神经元凋亡和焦亡、减少梗死体积的小胶质细胞活化,以增加神经元的重塑和功能恢复[12]。在大鼠缺血性卒中亚急性期,GMP级人脐带源性间充质干细胞 (hUCMSCs) 治疗有效改善了行为缺陷,减少了梗死体积和胶质瘢痕形成,促进了缺血半影区的血管生成 [13]。此外,在亚急性期,hMSCs 还通过抑制促炎细胞因子和M2到M1巨噬细胞/小胶质细胞表型的转变,来减少梗死周围区域的血脑屏障 (BBB) 受损和细胞凋亡 [14]。在慢性中风大鼠模型中,移植hUCMSCs可维持BBB完整性,减轻行为缺陷,并促进神经和血管再生[15]。这些研究表明间充质干细胞治疗大鼠急性、亚急性和慢性缺血性卒中是安全、可行和有效的。
中风临床试验研究
2005年,Bang等人前瞻性随机检查了30例大脑中动脉区域内脑梗死和严重神经功能缺损患者的,培养扩增自体MSCs移植的短期可行性、有效性和安全性。MSCs组患者在卒中7天内静脉输注1×108个自体MSCs,并随访长达1年。结果表明,MSCs可以促进功能恢复,并且没有报告任何与移植相关的不良事件 [16]。2010 年,他们还对85名严重大脑中动脉供血区梗死患者进行 iv MSCs 移植的长期安全性和有效性进行了评估。MSCs组患者接受iv自体提取培养的MSCs并随访长达5年。结果还表明,MSCs是安全的,可以促进功能恢复,具体取决于患者的发病特征,并且与血清基质细胞衍生因子-1水平和侧脑室室下区受累程度有关[17]。
随后,Jaillard等人在两项II期试验中,还证实了MSCs在亚急性卒中治疗上的安全性和可行性 [18,19]。同样,治疗慢性中风的研究也证明了MSCs的安全性、可行性和治疗效果 [20]。这些临床试验还表明,MSCs治疗对急性、亚急性和慢性缺血性卒中患者的治疗是安全、可行和有效的。
o3
MSC移植治疗缺血性脑卒中的潜在机制和治疗靶点
动物模型和临床试验研究表明,间充质干细胞可以有效治疗缺血性中风。间充质干细胞如何发挥治疗作用?间充质干细胞的治疗靶点是什么?如图 1所示,列出了MSCs 移植治疗缺血性卒中的潜在治疗靶点。
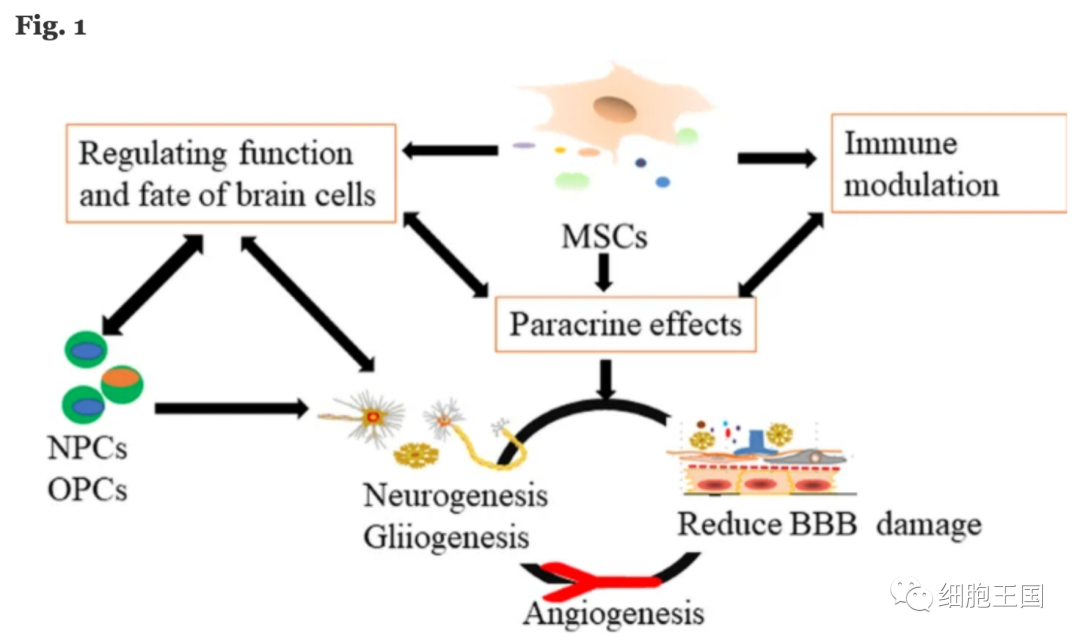
间充质干细胞移植治疗中可能的治疗靶点。
MSCs间充质干细胞、NPCs神经前体细胞、OPCs少突胶质祖细胞、BBB血脑屏障
旁分泌效应
MSCs可以通过旁分泌产生和分泌大量的趋化因子、细胞因子、神经营养因子和细胞外囊泡(EVs),通常称为MSCs分泌组。这些分子和EV将通过多种方式为MSCs移植治疗缺血性中风的治疗靶点提供有价值的见解,例如抗炎、抗凋亡、抑制纤维化、促进血管生成和神经发生、免疫调节等功能[21] 。我们将这些生物效应分子的作用,进一步总结在表1中。
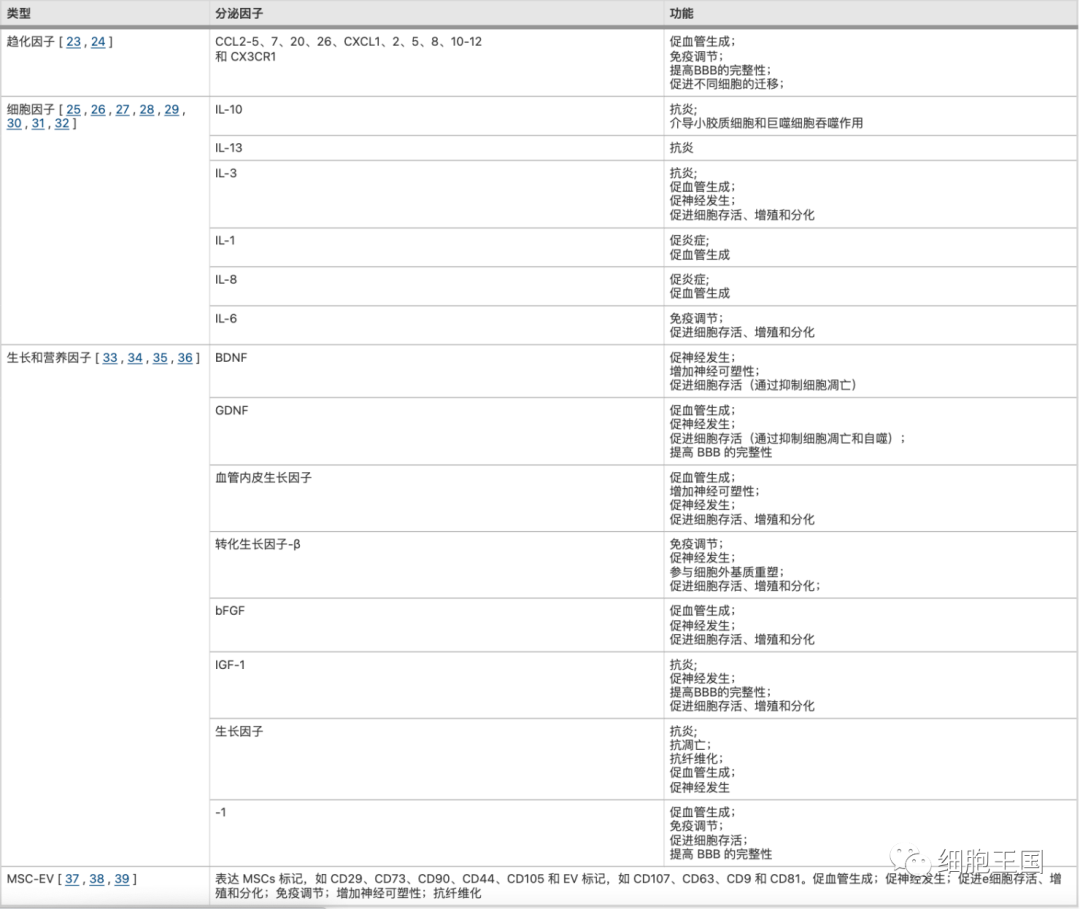
o4
MSC的免疫调节作用
体内和体外研究表明,间充质干细胞可以通过与适应性和先天免疫系统中的细胞相互作用来修复受损的脑组织来调节免疫。间充质干细胞的免疫调节功能是通过细胞与细胞间的接触和可溶性因子的释放来发挥的。图2显示了MSCs的免疫调节作用。
MSC介导的免疫调节的潜在机制。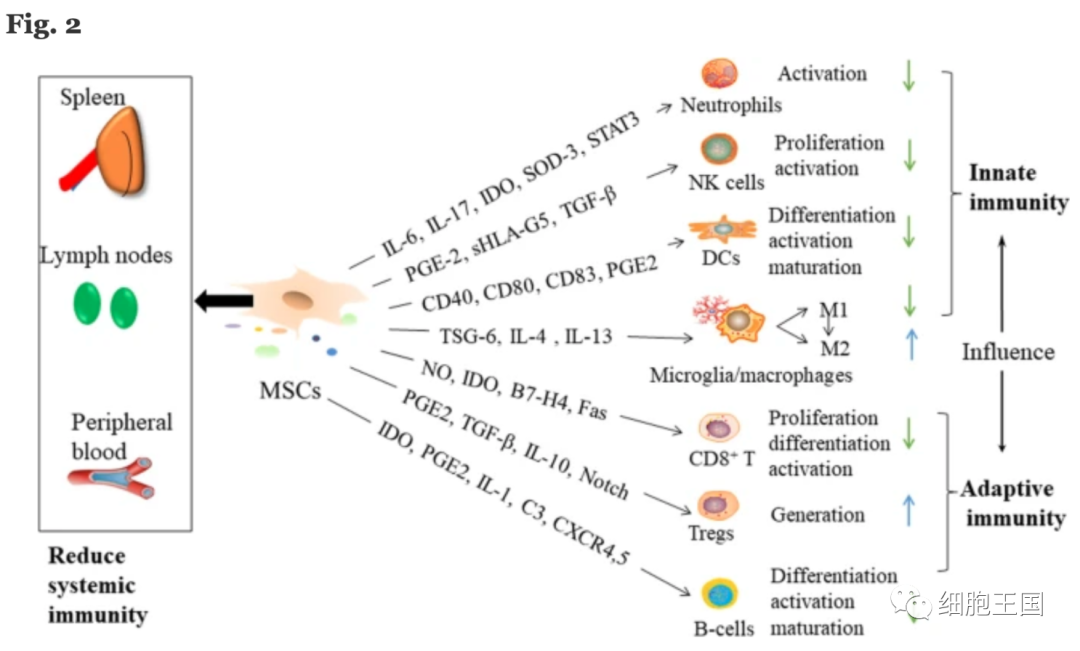
调节脑细胞的功能和命运
间充质干细胞还可以通过调节脑细胞的命运和功能来改善脑功能[3]。(图 3)描述了MSCs在中风后调节脑细胞命运和功能中的作用。
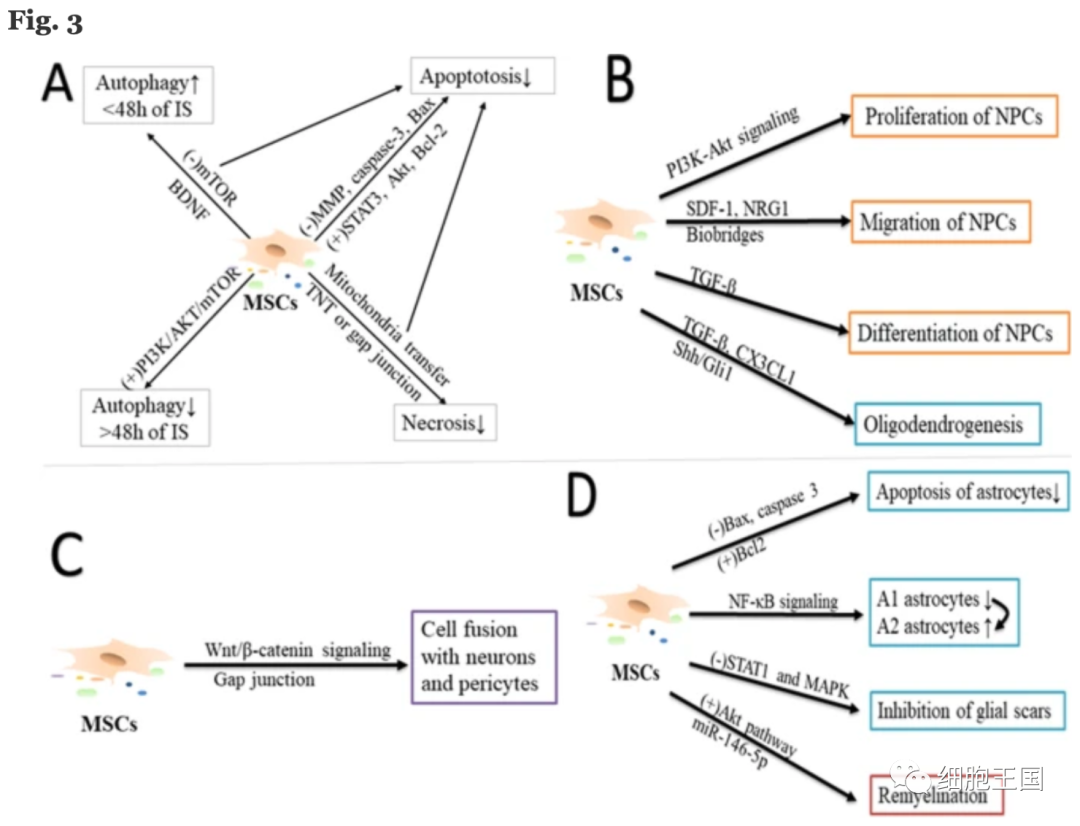
MSC介导的调节脑细胞功能和命运的潜在靶点。A MSCs影响脑细胞的自噬、凋亡和坏死,以提高缺血性中风后的细胞存活率。B MSCs促进内源性神经/少突胶质细胞前体细胞 (NPCs/OPCs) 的增殖、迁移和分化。C MSCs与神经元和周细胞的细胞融合。D间充质干细胞调节神经胶质细胞的功能
提高细胞存活率
自噬机制在脑缺血早期具有神经保护作用,在脑缺血持续时间较长时变为神经毒性作用。间充质干细胞移植可通过增加早期(缺血后24小时内)自噬来减少脑缺血损伤,并通过在后期(缺血后48-72小时)抑制自噬来提高神经元存活率。
细胞凋亡是细胞死亡的一种形式。MSCs移植还可以通过多种方式抑制细胞凋亡。例如,间充质干细胞可以通过在体内调节基质金属蛋白酶和STAT3和Akt的磷酸化来抑制细胞凋亡[64],抑制谷氨酸兴奋性毒性,降低Ca 2+和表面GluR1的水平 [65],或激活抗凋亡因子 Bcl-2并抑制脑缺血后内质网应激和促凋亡分子Bax[66]。
间充质干细胞还可以通过线粒体拯救受损细胞。据曾等人报道,在体外暴露于过氧化氢后 24小时,MSCs线粒体可以转移到神经元,这取决于细胞间的接触。在体内脑缺血后,受损脑微血管的宿主细胞接受移植的MSCs线粒体,从而显著改善受损微血管的线粒体活性,增强血管生成,减少梗死体积,促进功能恢复 [68]。这些研究表明,间充质干细胞可以通过将自己的线粒体转移到其他细胞中来拯救受损细胞。
促进内源性神经/少突胶质细胞前体细胞的增殖、迁移和分化
脑缺血可诱导神经发生和少突神经发生,不足以促进神经功能恢复。间充质干细胞可以促进神经发生和少突神经发生,改善神经功能恢复。据报道,MSCs移植通过增加趋化因子和聚唾液酸化酶的表达,显著增加了脑缺血条件下内源性神经前体细胞 (NPCs) 的增殖、迁移和分化[69]。
细胞融合
细胞融合是骨髓衍生细胞与转移其遗传物质并混合其细胞质的局部前体或成熟细胞的融合。研究表明,MSCs可以与多种不同的细胞融合,例如神经元、肝细胞、心肌细胞,甚至癌细胞。此外,间充质干细胞可以通过细胞融合修复受损的脑组织。坎普等人报道,在成熟的大脑中,骨髓衍生细胞与体内神经元的融合导致形成自发放电的神经元。此外,间充质干细胞还具有在间隙连接中介导细胞间通讯的潜力,从而启动细胞融合。间充质干细胞通过与内皮细胞的间隙连接对BBB的免疫调节和维持功能具有重要作用 [75]。因此,间充质干细胞可以通过与缺血性卒中后的神经元和周细胞融合来促进脑组织的修复。
神经胶质细胞的调节功能
胶质细胞是脑组织中除神经元外最重要的细胞亚群。胶质细胞包括星形胶质细胞、小胶质细胞和少突胶质细胞。星形胶质细胞是中枢神经系统中最丰富的神经胶质细胞。A2星形胶质细胞通过上调神经营养因子的表达发挥保护作用。A1星形胶质细胞在中枢神经系统损伤后迅速形成,并对髓鞘、突触和神经元产生神经毒性作用。间充质干细胞移植通过阻止星形胶质细胞凋亡和调节A2星形胶质细胞数量、抑制胶质瘢痕形成、通过调节缺血性卒中后NF-κB信号通路抑制轴突再生来发挥神经保护作用[77]。上述研究表明,间充质干细胞可以通过调节胶质细胞功能促进缺血性脑组织的修复。
o5
规范生产MSC
由Azizi等人在1998年发表了第一篇关于人间充质干细胞移植到大鼠脑中的报告可见,越来越多的人对间充质干细胞移植治疗神经系统疾病进行了研究。间充质干细胞移植治疗正逐渐从实验室走向临床治疗。尽管有许多注册的临床试验 ( http://www.clinicaltrial.gov/ ),但对于MSCs的制造并没有达成共识。从缺血性卒中患者的临床试验中获得的结果,已在荟萃分析研究中进行了分析 [79]。
临床初步证实了MSCs治疗是安全的,并且可以改善主要临床终点。然而,间充质干细胞作为先进的细胞治疗药物,需要符合GMP的生产和质量控制(包括设施管理、员工培训、制造程序和质量控制)。由于在MSCs生产和质量测试中缺乏经过验证、安全和可重复的程序,因此不同临床试验的结果通常是无法参考的。因此,很难就MSCs治疗对缺血性卒中的影响得出有效和普遍的结论。所以我们将重点关注GMP级MSCs生产中治疗靶点相关的生产工艺和质量控制,为MSCs在缺血性脑卒中治疗中的临床转化提供更多可能。
供体、细胞来源和培养过程
在临床级MSCs的大规模生产过程中,对供体资格(主要是年龄和病毒检测)进行筛选和检测非常重要。供体应避免MSCs可能涉及的其他异常风险。供体的年龄也是一个重要的标准,因为MSCs的增殖和多能性与供体的年龄直接相关[80],并且来自儿童的MSCs具有更高水平的分化能力及活性 (CFU-Fs) [81]。
细胞分离技术是干细胞用于再生医学、体外扩增和潜在临床应用之前的非常重要的步骤。是获得足够材料和提高MSCs治疗效率的主要因素 [4,82]。目前,最常报道的MSCs来源是骨髓、脂肪组织以及新生儿和胎儿组织衍生的MSCs。与体外骨髓间充质干细胞相比,ADMSCs 似乎表现出更高的增殖潜力并更快地产生临床有效的细胞剂量 [84]。最近的研究表明,来自脐带的符合GMP的临床级MSCs的易获取和具有更高的增殖潜力,是GMP生产的推荐来源[85]。
体外扩增MSCs的对照
冷冻保存可维持MSCs的细胞功能(例如,免疫调节和分化能力)和存活率,然而,在将 MSCs移植到动物或患者体内之前,冻融细胞的瞬时升温会损害MSCs在体外的扩增、活力和效力,并破坏部分细胞膜,这可能会改变IFN-γ受体的信号传导并下调吲哚胺的表达2,3-双加氧酶 (IDO) [90],损害MSCs的免疫调节功能,增强免疫细胞和补体系统裂解的脆弱性,并降低静脉给药后的体内持久性[91]。
目前,已经报道了多种对MSCs的复苏方法来提高其治疗效果,包括缺氧、3D培养、药物、细胞因子和生长因子。例如,持续的低氧张力通过激活糖酵解改善了MSCs的生长和遗传稳定性 [92]。3D载体培养可以促进MSCs扩增并增加抗炎特性 [40,93]。寡霉素或促炎细胞因子通过激活AMPK信号传导增加MSCs的免疫抑制特性 [94]。GMP级hUCMSCs的代谢重编程增加了它们在急性移植物抗宿主病中的抑制潜力[95]。
尽管有许多方法可以提高MSCs 培养规模并将MSCs用于临床应用,但仍有许多机构尚未符合GMP级标准化生产。
MSCs的效力测定
在临床试验中,MSCs的效力测定是必不可少的,其中包括MSCs的表面标志物、分化潜能、衰老状态、分泌组和免疫调节功能 [4]。芬尼等人建立“临床适应症预测量表”(CLIP)并报道转录因子Twist1调节MSCs的功能。换言之,Twist1高表达的MSCs具有生长快、CFU-Fs活性高、内在细胞凋亡水平低和促血管生成表型的特征,而Twist1低表达的MSCs 具有抗炎和抗炎的特征。免疫调节活性 [96]。钦纳杜赖等人通过定量RNA序列和分泌组分析估计了MSCs和外周血单核细胞之间的体外免疫调节能力。结果表明,MSCs通过大量介导IDO抑制T细胞增殖,这与CXCL9、CXCL10、VEGF和CCL2的分泌和表达有关[97]。在MSCs-外周血单核细胞共培养环境中,循环分析方法显示MSCs中STAT1和STAT3的磷酸化与T细胞抑制相关 [98]。因此,应结合MSCs异质性、分子标记和局部微环境的高度复杂性,进一步探索验证MSCs身份和质量的效力测定。
至此本文阐述了用于缺血性中风的GMP级MSC的生产。现有研究的结果提供了有关干细胞治疗的安全性和可行性的数据。由于患者群体、细胞来源、给药时间和给药方法的差异,需要解决定义和实施相关安全控制的难点,特别是测试遗传稳定性和严格的效力测定,以标准化MSC治疗并避免结果偏差。
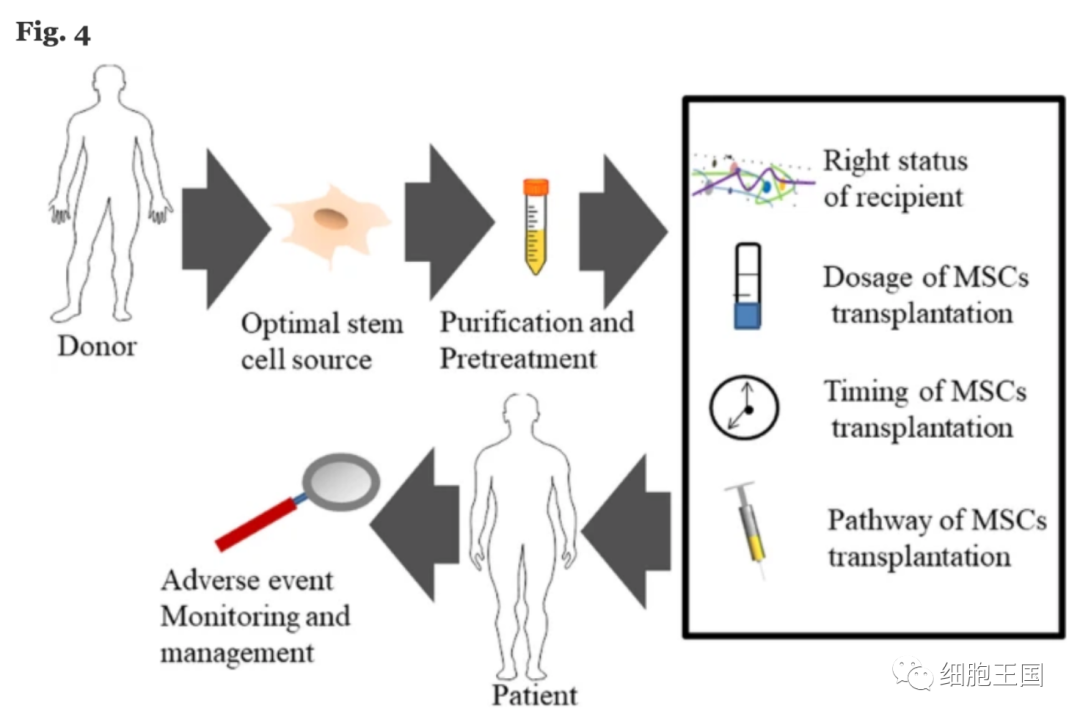
基于MSC的临床应用考虑的关键考虑。
总之,MSCs可以用作中风治疗的候选细胞治疗药物,具有改善缺血性患者的神经功能、存活率和生活质量的潜力。
参考资料:暂不提供
编辑:小果果,转载请注明出处:https://www.cells88.com/cells/gxb/12930.html
免责声明:本站所转载文章来源于其他平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请及时告知,我们会在24小时内删除相关信息。
说明:本站所发布的案例均摘录于文献,仅用于科普干细胞与再生医学相关知识,不作为医疗建议。


 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫